

![]()
Aspectos funcionales
 El proceso de exocitosis es un mecanismo
fisiológico muy dinámico que según el tipo de vesículas o
tipo celular tiene características especiales. Así la respuesta
a un estímulo tiene un retardo en la respuesta exocitótica de
fracciones de mseg para el caso de la liberación de la
acetilcolina en la unión neuromuscular (UNM) .
El proceso de exocitosis es un mecanismo
fisiológico muy dinámico que según el tipo de vesículas o
tipo celular tiene características especiales. Así la respuesta
a un estímulo tiene un retardo en la respuesta exocitótica de
fracciones de mseg para el caso de la liberación de la
acetilcolina en la unión neuromuscular (UNM) .
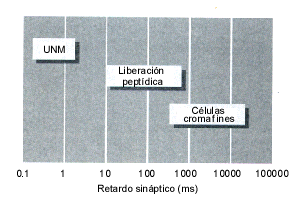
A nivel de un terminal nervioso el retardo sináptico es de 10 mseg para sinapsis de NT rápidos tipo GABA y glutamato y de más de 100 mseg para las sinapsis lentas tipo noradrenalina o péptidos. En las células secretoras como las células cromafines o los mastocitos el proceso de exocitosis puede tener un retardo de varios segundos hasta minutos. Esta variación en tiempo de exocitosis significa un acople de la maquinaria exocitótica diferente y una participación de distintos elementos moleculares. Esto vuelve a indicarnos que sobre un mecanismo básico, igual a la exocitosis constitutiva, existen mecanismos regulados y especializados para los diferentes tipos de células.
Existen técnicas de microscopía electrónica y de microscopía de luz de gran potencia por las cuales se pueden visualizar las vesículas sinápticas en sus diversos estadíos y su relación con los otros elementos de la membrana celular y la sinapsis. Un enfoque de gran valor para el estudio funcional de la sinapsis ha sido por las técnicas electrofisiológicas y ópticas con marcadores fluorescentes. Estas son técnicas rápidas y localizadas para estudiar el proceso de exocitosis. El problema más grande de estas técnicas ha sido poder diferenciar entre los elementos postsinápticos y presinápticos es decir si estamos midiendo un cambio en la velocidad de liberación a nivel presináptico o un cambio en la eficiencia de los receptores postsinápticos. Otro enfoque de gran utilidad en resolver preguntas a este nivel han sido las técnicas bioquímicas. Estas han servido para caracterizar los diferentes elementos moleculares, como también estudiar la liberación de los NTS aunque con una resolución temporal y celular menor.
Así se han acumulado evidencias que las vesículas son el elemento que acumula y libera a los NTS y múltiples otras sustancias, las evidencias son las siguientes: 1- Todas las sinapsis químicas presentan vesículas. 2- Vesículas sinápticas tienen mecanismos (bombas) para captar y almacenar al NT. 3- Por la técnica de microscopía electrónica por criofractura se puede correlacionar exocitosis de vesículas con el momento de la liberación. 4- Proteínas vesiculares aparecen en la membrana plasmática. 5- Drogas que inhiben o aumentan la recaptura vesicular del NT pueden aumentar o disminuir la cantidad del NT liberado. 6- Vesículas se pueden cargar con marcadores fluorescentes tomados por endocitosis y luego liberados por estimulación subsecuente. 7- Toxinas (tetánica y botulínica) que interfieren con la fusión de vesículas a la membrana celular bloquean la secreción. 8- En la mayoría de las circunstancias a nivel de la unión neuro- muscular, la liberación de una vesícula corresponde a la respuesta post-sináptica cuántica medida como un PEPS ( potencial exitatorio post sináptico).
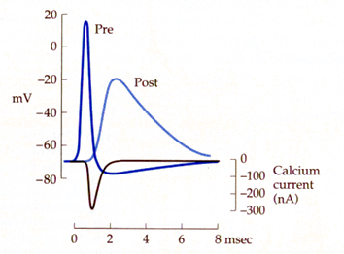 La liberación de
los NT de estas vesículas y su difusión a través del espacio
sináptico se realiza en 200 µseg a nivel de la UNM. La
concentración de acetilcolina a nivel sináptico puede llegar a
1 mM. Al activarse los receptores, se abren canales iónicos
postsinápticos en un lapso de 1,5 mseg. Desde la generación del
potencial de acción presináptico hasta la aparición del
postsináptico, PEPS, existe un retardo sináptico de 0.5 mseg en
el caso de la UNM que puede llegar hasta varios mseg como es el
caso de la sinapsis gigante de calamar como se ve en la gráfica
(Llinas 1982). También en sinapsis rápidas del glutamato o de
GABA a nivel del sistema nervioso central se han descrito tiempos
parecidos con una respuesta postsináptica menor.
La liberación de
los NT de estas vesículas y su difusión a través del espacio
sináptico se realiza en 200 µseg a nivel de la UNM. La
concentración de acetilcolina a nivel sináptico puede llegar a
1 mM. Al activarse los receptores, se abren canales iónicos
postsinápticos en un lapso de 1,5 mseg. Desde la generación del
potencial de acción presináptico hasta la aparición del
postsináptico, PEPS, existe un retardo sináptico de 0.5 mseg en
el caso de la UNM que puede llegar hasta varios mseg como es el
caso de la sinapsis gigante de calamar como se ve en la gráfica
(Llinas 1982). También en sinapsis rápidas del glutamato o de
GABA a nivel del sistema nervioso central se han descrito tiempos
parecidos con una respuesta postsináptica menor.
Zona activa
La exocitosis de los terminales nerviosos como también de muchas células secretorias se realiza a nivel de una zona activa. Este concepto viene de diversos estudios de localización y cinética de activación de canales de Ca++ que pueden llegar a elevar de manera muy rápida ( 200 µseg) a concentraciones de Ca++ de 100 µM. Este tipo de arreglo se ha visto asociado a vesículas de transmisión rápida como son las SSV en el cual el sitio activo coincide con la sinapsis y tambien las vesículas LDCV o gránulos de transmisión más lentas, aunque no están asociados a sinapsis.
Dependencia de Ca++ en la exocitosis
Un elemento importante en la exocitosis es la presencia y aumento de concentración de Ca++ intracelular. Como se puede apreciar en la misma gráfica las corrientes de Ca++ suben en un lapso de mseg de concentraciones basales de Ca++ libre de 100 nM a concentraciones superiores 100 µM una vez depolarizada el terminal presináptico. Estos cambios en la concentración de Ca++ pueden variar según el tipo de estimulación y también según el tipo de célula. Así en la siguiente gráfica podemos apreciar
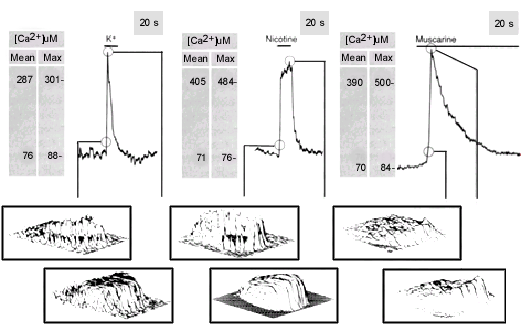
la respuesta de una célula cromafínica vista como señales de fluorescencia de agentes que se unen al Ca++, a diferentes tipos de estimulación a) muestra una despolarización por altas concentraciones de cloruro de potasio (ClK) (30 mM) que produce una rápida espiga de Ca++ que se observa inicialmente como una corona de la membrana plasmática de la célula y luego en su máximo se observa como un sombrero al subir las concentraciones de Ca++ más uniformemente en toda la célula. b) muestra la célula estimulada por nicotina, que activa receptores ionotrópicos (es decir abre directamente canales iónicos e induce la depolarización) semejante a la respuesta a la de ClK con una rápida espiga pero de mayor amplitud y duración de la respuesta. En c) la estimulación es con muscarina, que activa receptores metabotópicos que activan a G proteínas (proteínas reguladas por nucleotidos de guanina con la consecuente activación de segundos mensajeros), aquí se observa un aumento rápido pero más uniforme a nivel de toda la membrana plasmática de la célula que se mantiene por varios segundos y presenta polarización a nivel de un lado de la célula. Estos cambios de concentración de Ca++ tan variados se pueden correlacionar con el proceso de exocitosis combinando diferentes técnicas de medición de corrientes de Ca++ con medidas de capacitancia, medición fluorométricas de Ca++, con registros amperométricos y otros. De esta forma se ha podido establecer que el umbral de Ca++ para inducir la exocitosis puede variar desde los 300 nM en sinapsis rápidas del tipo colinérgico hasta los 100 µM en secreción lenta, de gránulos peptídicos y células secretoras.
¿A qué se debe esta variabilidad en tiempos y concentraciones de Ca++ necesarios para la exocitosis y sitios específicos de activación ?
El Ca++ se encuentra altamente regulado en todas las células para mantener un gradiente de Ca++ citoplasmático de100 nM contra 2 mM de Ca++ extracelular y además lograr una recuperación rápida de los niveles basales una vez activada la célula.
Para lograr el aumento rápido del Ca++ citoplasmático se han descrito múltiples canales de Ca++ voltaje sensibles (VDCC) a nivel de la membrana celular que están involucrados con la activación y entrada de Ca++, previa despolarización de la membrana, y con la subsiguiente liberación de los NTS. Estos canales VDCC, asociados a exocitosis son del tipo de N , L o P/Q dependiendo del tipo celular. Se ha podido aislar el canal de Ca++ tipo N y P/Q junto con la sintaxina a nivel de la membrana plasmática. También existen canales de Ca++ activados por agonistas como el glutamato , ATP y otros. Estos canales tienen cinéticas diferentes y se activan a diferentes niveles de despolarización de la membrana, lo que puede generar un patrón mas rápido o más lento de la activación de la maquinaria exocitótica. Igualmente se ha descrito su localización es zonas activas específicas a nivel de la membrana celular que hace que existan sitios que rápidamente (200 µseg) detecten una alta concentración de Ca++ ( > 100 µM) al abrirse el canal durante la despolarización. Así se considera que las vesículas SSV al estar ancladas a los sitios activos en gran cercanía (alrededor de 10 nm) de los canales VSSC pueden fusionarse y liberar el NT en fracciones de mseg. Esto aparentemente también sucede cuando se estimula una célula o terminal sólo por tiempos cortos (mseg) o durante pocos potenciales de acción y se fusionan las vesículas del tipo SSV y ocurre así una liberación moderada y muy localizada. Una despolarización más fuerte o prolongada y/o la movilización de Ca++ intracelular puede incrementar las concentraciones de Ca++ citoplasmáticas de manera uniforme y de esta manera inducir la exocitosis de las vesículas del tipo de LDCV o gránulos peptídicos. Este tipo de liberación es obviamente más lenta, con un retardo hasta de 10 seg como en el caso de los gránulos en células acinares.
Un factor fundamental en la regulación del Ca++ citoplasmático son los canales de Ca++ de organelas intracelulares. Así existen los canales de tipo IP3 activados por receptores metabotrópicos ligados a la activación de la fosfolipasa C y a la cascada de dos mensajeros del tipo de IP3. Estos canales son capaces de liberar Ca++ e inducir exocitosis con una cinética más lenta y por tiempos más prolongados. También los canales de Ca++ del tipo de rianodina han sido asociados con la regulación de la liberación en diferentes tipos de células y terminales nerviosos. Aparentemente la activación de la liberación de sustancias de células endocrinas y exocrinas dependen más de la activación de este tipo de canales intracelulares y aumento del Ca++ citoplasmático que de la activación por canales de Ca++ de membrana plasmática es decir de la entrada de Ca++ externo.
Otro elemento muy importante en la regulación de las concentraciones internas de Ca++ y la regulación de la exocitosis son los tampones citoplasmáticos de Ca++. Así se han descrito diversas proteínas capaces de ligar el Ca++ y regular los niveles de Ca++ citoplasmático entre ellos se encuentra la calmodulina, parvalbumina, calretinina, calbindina, entre otros. Todas estas proteínas tienen una distribución y cinética diferenciales y son capaces de regular de manera específica el mecanismo de liberación. Estos tampones hacen también que la difusión del Ca++ al entrar a la célula por sus canales específicos se mantenga localizado en los sitios activos, así un estímulo corto de pocos potenciales de acción sólo será capaz de inducir una liberación localizada de vesículas ya ancladas a la membrana . Este es el caso en general de la transmisión rápida del tipo de las vesículas SSV. En el caso de un estímulo mayor y por más tiempo para elevar las concentraciones de Ca++ citoplasmático de forma más uniforme también se logra activar las vesículas o gránulos mas alejados del sitio activo e induce su exocitosis como es el caso de las vesículas del tipo LDCV y los gránulos peptídicos.
Los mecanismos de liberación rápidos y transitorios del tipo de la liberación de SSV y la liberación más lenta y prolongada de las LDCV también se pueden explicar por la asociación con receptores de Ca++ (proteínas específicas que unen el Ca++ y están ligadas a la maquinaria exocitótica) de baja afinidad para el mecanismo rápido y transigente y de alta afinidad para la liberación lenta. No está claro cuáles son las proteínas que están ligadas a uno u otro proceso pero deben ser múltiples proteínas.
Liberación de varios neurotransmisores o sustancias de un mismo terminal o célula
Un mismo terminal nervioso o célula puede tener diferentes tipos de vesículas cada una con un tipo de neurotransmisor. Estas vesículas son liberadas con una cinética diferente como se explica arriba, así las vesículas pequeñas, son las primeras en liberarse y ejercen su función en el espacio sináptico o extracelular seguidas por la liberación de las vesículas mas lentas, con función prolongando y potenciando el efecto primario; también pueden tener acciones inhibitorias regulando negativamente el efecto del primer neurotransmisor liberado.
Regulación sináptica de la liberación
Como hemos visto arriba la liberación y específicamente la exocitosis tienen muchos elementos involucrados en su mecanismo que pueden ser regulados. Una forma muy importante de regulación de la liberación es por fosforilación de múltiples proteínas asociadas al proceso de exocitosis. Así la quinasa activada por la calmodulina (CaMKII) puede fosforilar a sinaptofisina, sinaptobrevina, synaptotagmina, rafilina, SNAP, NSF, sintaxina, y también canales de Ca++ tipo N. La quinasa proteína C fosforila a sinaptobrevina, rabphilina, SNAP 25, Munk 18 y canales de Ca++ tipo N. La quinase de caseína fosforila a sinaptotagmina y la sintaxina. La quinasa dependiente de ciclina fosforila a Munk 18.
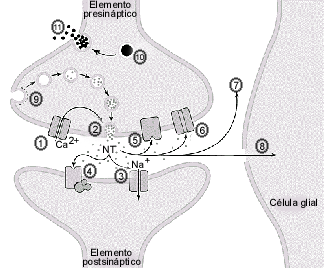 Además de los
mecanismos de fosforilación que regulan la liberación, existen
diversos factores presinápticos que modulan directa o
indirectamente la liberación. Así tenemos (1) la entrada
de Ca++ que es primordial en la exocitosis. Una vez
liberado el NT (2) es capaz de actuar a nivel
post-sináptico a nivel de los receptores específicos
ionotrópicos y metabotrópicos (3-4). nivel
presináptico.
Además de los
mecanismos de fosforilación que regulan la liberación, existen
diversos factores presinápticos que modulan directa o
indirectamente la liberación. Así tenemos (1) la entrada
de Ca++ que es primordial en la exocitosis. Una vez
liberado el NT (2) es capaz de actuar a nivel
post-sináptico a nivel de los receptores específicos
ionotrópicos y metabotrópicos (3-4). nivel
presináptico.
A nivel presináptico los NTS pueden activar hetero-receptores presinápticos que son capaces de inhibir o aumentar la liberación de NTS. También a nivel presináptico encontramos los auto-receptores (5) , es decir los que son activados por el mismo NTS del terminal . De esta manera el NTS ejerce una retro alimentación negativa y en ciertos casos excepcionales, retro alimentación positiva, del proceso de liberación. Los transportadores del NTS a nivel de la membrana plasmática (6) ayudan a eliminar el NTS del espacio sináptico y así regulan la respuesta del NTS a nivel post-sináptico. Este transportador es capaz de funcionar de manera reversa, es decir no recaptura al NTS sino lo libera al espacio extracelular. Esto se ve en algunas situaciones como despolarización prolongada, aumento de la concentración citoplasmática del NT o inducido por drogas específicas que actúan sobre el transportador. Este tipo de liberación no es Ca++ dependiente sino depende del gradiente del sodio (Na). A nivel presináptico también se efectúa la síntesis y llenado de las vesículas (9) como fue descrito arriba. A este nivel también se regula la liberación en el sentido que existen condiciones en las cuales farmacológicamente o por toxinas no se obtiene el reciclaje (endocitosis) de las vesículas o su llenado normal. Esto se refleja en una disminución o bloqueo de la liberación. Las vesículas densas o los gránulos peptídicos tienen mecanismos de regulación particulares (10) que no siempre coinciden con los de las vesículas pequeñas. Así la dependencia de Ca++ de ellas es de baja afinidad, más lento y la exocitosis no se realiza a nivel de sinapsis, siendo activado por estímulos de más intensidad y mas prolongado (mayor frecuencia de estimulación). Igualmente los NTS peptídicos no tienen el sistema de recaptura descritos para los NTS clásicos ni a nivel de la membrana plasmática, ni a nivel de las vesículas por lo que no tienen el tipo de liberación Ca++ independiente, por reversión del transportador.
![]()