

![]()
La lucha
biológica mediante moluscos competidores
Marisa cornuarietis
Las primeras observaciones de campo sobre fenómenos de competencia fueron realizadas en Puerto Rico entre el ampularido Marisa cornuarietis y Biomphalaria glabrata, hospedero intermediario de Schistosoma mansoni (O.M.S, 1982). Marisa cornuarietis se introdujo accidentalmente en esa isla después de la Segunda Guerra Mundial y después de 1952, el impacto de esta especie sobre B. glabrata ha sido observado en el medio natural (Olivier-Gonzalez et al., 1956). Seguidamente, se implementaron con éxito varios programas de lucha biológica en lagunas de irrigación (Palmer et al., 1969), lagos artificiales (ovni et al., 1977) así como en algunos cursos de agua (Jobin y Laracuente, 1979).
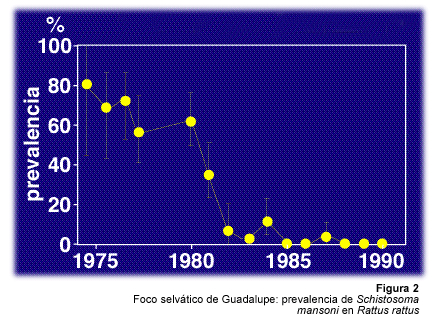
En Guadalupe, M. cornuarietis se introdujo en 1987 en un estanque, el Grand Etang, que constituía un foco selvático de Schistosoma mansoni. Este foco se caracterizaba epidemiologicamente por la presencia de poblaciones de ratas negras Ratus ratus, con una alta prevalencia de Schistosoma mansoni, por poblaciones de Biomphalaria glabrata, medianamente infectadas y por la ausencia de participación del hombre en el ciclo parasitario. Marisa cornuarietis es un molusco herbívoro muy voraz. Su introducción en el Grand Etand tuvo como consecuencia la eliminación de una planta flotante, Pistia stratiotes, desde 1989. Esta planta constituía el hábitat casi exclusivo de B. glabrata. Muestreos realizados en 1990 y 1991 confirmaron la erradicación de B. glabrata y del parásito S. mansoni en la rata (Figura 2)(Pointier et al., 1991). Marisa cornuarietis fue también introducida en las lagunas de Grande-Terre en Guadalupe, donde se constató la misma eficacia que en el foco selvático (Pointier y Theron, 1995).
Paradójicamente, la utilización de M. cornuarietis en Venezuela, país de origen de esta especie, no ha producido nunca resultados positivos en los diferentes sitios de transmisión de S. mansoni, en aquellas zonas donde se introdujo esta especie. Sin embargo, este ampulárido invadió numerosos lagos artificiales en todo el país donde, asociado con los tiáridos, limitó fuertemente las poblaciones de Biomphalaria (Balzán, comunicación personal).
Tarebia granifera
Este molusco es original del sureste de Asia, y se encuentra actualmente expandido por toda la región intertropical. Fue introducido accidentalmente en Texas alrededor de 1935 (Murria y Woopschall, 1965), luego en Florida entre 1940 y 1947 (Abbot, 1952). Seguidamente, se introduce en Puerto Rico alrededor de 1954 (Harry y Aldrich, 1958) donde se hicieron las primeras observaciones sobre el desplazamiento competitivo de B. glabrata por esta especie a lo largo de un curso de agua entre 1964 y 1969 (Butlers et al., 1980). Otras observaciones realizadas en esta isla muestran que T. granifera es capaz de colonizar numerosos tipos de hábitat tales como arroyos, ríos, canales, charcas, lagos y pantanos permanentes. Este molusco es muy resistente a la polución pero bastante sensible a la desecación y por lo tanto muestra una baja supervivencia en cuerpos de agua temporales. Por otra parte, su crecimiento y su tasa de reproducción son bajos en comparación con Biomphalaria (Chaniotis et al., 1980).
En Venezuela, T. granifera es encontrada por primera vez en 1970, en un lago artificial cerca de Caracas. Luego, en los años siguientes es vista en otros dos lagos: Ocumarito y Camatagua (Chrosciechowski, 1973). En Camatagua un inventario malacológico realizado en 1963 había revelado la presencia de varias especies de Biomphalaria. En 1974, el lago fue colonizado totalmente por T. granifera y ningún ejemplar de Biomphalaria pudo ser colectado (Chrosciechowski, comunicación personal). En 1975, los ríos de la región litoral central de Venezuela fueron invadidos por T. granifera. Antes de esa fecha, muchos de esos ríos albergaban a B. glabrata y constituían sitios de transmisión de S. mansoni. Inventarios malacológicos realizados entre 1975 y 1983, y luego en 1990 mostraron la desaparición total de B. glabrata de estos ríos y la presencia de importantes poblaciones de tiáridos (Pointier et al., 1994).
Tarebia granifera ha invadido igualmente las demás islas de las Antillas Mayores como son: República Dominicana, Haití y Cuba entre 1965 y 1970 (Jaume, 1972; Ferguson, 1977) y más recientemente las Antillas Menores como Martinica en 1991 (Pointier et al., 1998) y Guadalupe en el 2000 (datos no publicados). Por lo tanto, la expansión de esta especie sigue progresando en la región del Caribe.
Un estudio de introducción de esta especie se realizó en dos localidades diferentes de Cuba y se observó la disminución de algunas especies de Biomphalaria allí presentes (Perera et al., 1993). En República Dominicana se obsevó también este mismo fenómeno (Gómez et al., 1990).
Melanoides tuberculata
Esta especie pertenece a la misma familia de Tarebia granifera, y ha sido a menudo confundida en la literatura con esta última. Originaria de África del Este y del Medio Oriente, ha invadido igualmente toda la región intertropical. Su llegada a la región neotropical es un poco tardía ya que se reporta por primera vez en Texas en 1964 (Murray, 1964). Seguidamente, esta especie colonizó los mismos países e islas del Caribe que T. granifera (ver la revisión de Pointier y McCullough, 1989).
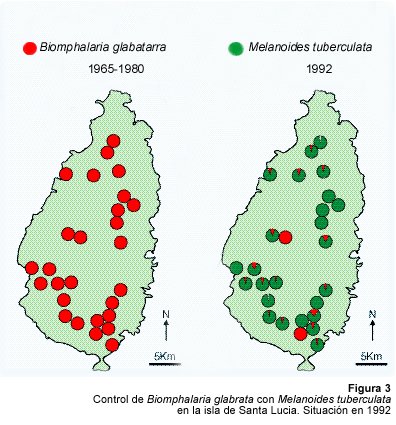
El primer ensayo de lucha biológica, usando a Melanoides tuberculata, se realizó en la isla de Santa Lucía en 1978. Una cepa proveniente de la isla vecina de Dominica, fue introducida ese año en varios sitios de transmisión de S. mansoni. Esos sitios, bien conocidos en Santa Lucía, comprendían zonas cenagosas cultivadas e irrigadas por pequeños arroyos y fuentes. Dos años después de su introducción, M. tuberculata había colonizado ampliamente todo el área y había eliminado las poblaciones de B. glabrata (Prentice, 1983)(Figura 3). Después de este primer éxito, M. tuberculata fue introducida en otras zonas de la isla entre 1981 y 1986 (Calender, comunicación personal). Un inventario malacológico realizado en 1992 mostró que la mayor parte del sistema hidrográfico había sido invadido por M. tuberculata y que las poblaciones de B. glabrata habían disminuido significativamente (Pointier, 1993).
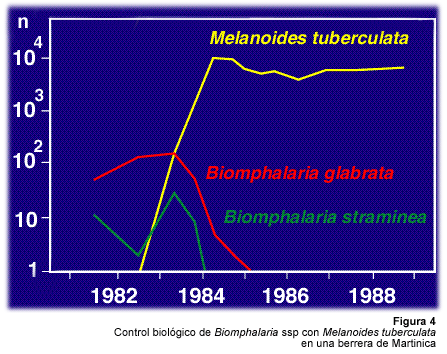
En 1983, persistía la transmisión residual de S. mansoni en berreras de Martinica. Se intentó entonces un primer ensayo de lucha biológica utilizando M. tuberculata en un grupo de berreras de la región de Saint-Pierre. En menos de dos años, el competidor había eliminado las poblaciones de B. glabrata y de B. straminea, que se encontraban en esas berreras (Pointier et al., 1989) (Figura 4).
Todas las demás berreras que habían sido encuestadas en la isla fueron luego tratadas de la misma forma y en 1990, las poblaciones de B. glabrata y de B. straminea habían casi desaparecido de ese tipo de hábitat (Pointier y Guyard, 1992)(Tabla 1). Paralelamente a este programa específico de lucha biológica, un seguimiento malacológico regular mostró que casi todos los cursos de agua de la isla habían sido invadidos progresivamente por M. tuberculata, mientras que las poblaciones de B. glabrata y de B. straminea devenían rápidamente en especies raras (Schlegel et al., 1997). En el año 2000 no fue posible encontrar B. glabrata en Martinica, mientras que B. straminea devino una especie poco común (datos no publicados).

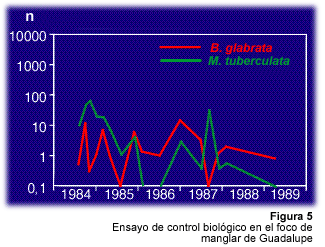
El caso de Guadalupe es diferente al de Martinica. M. tuberculata se descubrió por primera vez en esa isla en 1979. Durante los años siguientes, esta fue introducida en varios canales y cañadas de Basse-Terre que eran sitios de transmisión de la parasitosis y ocasionó la desaparición progresiva de B. glabrata (Pointier y Theron, 1995). Por el contrario, no se tuvo éxito al implementar un ensayo de lucha biológica en 1984 en zonas cenagosas situadas detrás de la region de manglar de Grande-Terre (Pointier et al., 1993). En efecto, en ese tipo de habitat M. tuberculata y B. glabrata pueden coexistir sin que se observe exclusión alguna. La explicación de este fenómeno está en relación con el hecho de que las zonas cenagosas son muy heterogéneas y están sometidas a períodos irregulares de desecación e inundación. En este tipo de hábitat, B. glabrata, que tiene un ciclo de vida corto, un crecimiento y una tasa de reproducción elevadas, posee una ventaja adaptativa con respecto a M. tuberculata, que tiene un ciclo de vida más largo con una tasa de crecimiento más lenta y una tasa de reproducción mucho más baja (Pointier et al., 1991). Melanoides tuberculata no cuenta, por tanto, con el tiempo necesario para alcanzar densidades suficientemente elevadas para que ocurran los fenómenos de competencia, como ocurre en el caso de los cuerpos de agua permanentes de Santa Lucía, Martinica o la Basse-Terre de Guadalupe (Figura 5). El éxito de la lucha biológica depende del tipo de hábitat donde esta será aplicada.
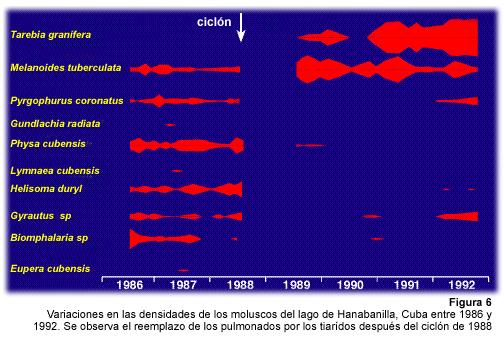
En Cuba, un estudio a largo plazo realizado en el lago Hanabanilla demostró un reemplazo de diferentes especies de pulmonados como consecuencia del aumento de las densidades de M. tuberculata y T. granifera a partir de la aparición de estas especies en ese lago (Perera et al., 1995) (Figura 6).
![]()