



Actividades
proteolíticas, hemorrágicas y coagulantes del veneno
Los venenos de Viperidae contienen diversas actividades enzimáticas como son las fosfolipasas, fosfodiesterasas, fosfomonoesterasas, alfa-aminoacidooxidasas, acetilcolinesterasas, enzimas proteolíticas de la serina-proteinasa y varias clases de metaloproteinasas, arginina-esterasa, 5'nucleotidasa, hialuronidasa y NAD nucleosidasas. No todas las enzimas están presentes en todos los venenos. Entre los péptidos encontrados están las neurotoxinas presinápticas y post-sinápticas. Los canales de potasio son importantes en la actividad de las neurotoxinas, citotoxinas, miotoxinas, cardiotoxinas y los inhibidores de agregación plaquetaria (desintegrinas) (Markland., 1998).
En lo que respecta a las actividades hemorrágicas y proteolíticas de serpientes suramericanas (Monterrey, 2000), ellas existen casi exclusivamente en los venenos botrópicos y lachésicos. Sin embargo, en los últimos años, se han comenzado a describir estas actividades en algunas especies de crótalos venezolanos (Rodriguez-Acosta et al., 1998; Aguilar et al., 2001).
El volumen de veneno inyectado determina la severidad de la lesión, pero en todos los casos de accidente ofídico por Bothrops se produce necrosis de los tejidos blandos. En adición, la acción proteolítica produce aminas y péptidos vasoactivos, tales como: bradiquinina, histamina y serotonina que causan lesión capilar, lo cual se traduce por hemorragias petequiales, hematuria, hematemesis, epistaxis y hemorragias viscerales (Toro et al., 1983).

La actividad de los venenos bothrópicos tiene componentes citotóxicos y fibrinolíticos, los cuales producen necrosis y hemorragias en tejido nervioso y por supuesto en otros tejidos. Ellos en su mayoría, poseen una acción tipo trombina: se consume fibrinógeno, para formar un monómero de fibrina, poco estable e incapacitado para polimerizar y formar coágulos sanguíneos (Gutiérrez et al., 1980).
El colapso sistémico observado en algunos pacientes hace sospechar una actividad sobre las glándulas suprarrenales, la cual ha sido poco descrita desde el punto de vista ultraestructural. Su actividad sobre los tejidos musculares, sistema nervioso central (SNC) y periférico (SNP) tampoco ha sido extensamente estudiado. En el sistema nervioso central existen pocos estudios morfológicos con microscopía de luz en otros géneros de serpientes con fuerte actividad hemorrágica de su veneno (Than et al., 1989). No se encontraron estudios ultraestructurales en una revisión bibliográfica de los últimos 20 años sobre el tema.
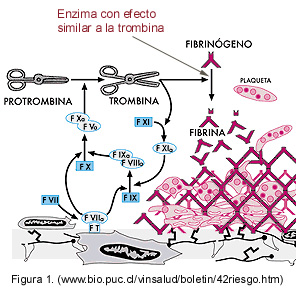
Algunas serpientes Viperidae contienen enzimas, tales como: batroxobina de Bothrops asper, marajoensis y moojeni; la reptilasa de B. atrox y la mutasa de Lachesis muta (Kamiguti et al., 1991). Dentro de la misma familia, los venenos Bothrópicos son mezclas complejas que contienen diferentes enzimas, toxinas y sustancias, entre ellas: proteinasas, particularmente la enzima semejante a la trombina (Figura 1) responsable de la coagulación de fibrina en la fase de coagulación de la sangre (Zaganelli et al., 1996).
Otras enzimas descritas son las fosfolipasas A2. Bothropstoxina I (Bthtx-I) y II ( BthtxII), que fueron purificadas y caracterizadas del veneno de Bothrops jararacussu. La fosfolipasa A2 miotóxica fue aislada de Bothrops asper (Gutierrez et al., 1990 ), y la miotoxina básica, del veneno de la Bothrops nummifer, (Gutierrez et al., 1980; Chaves et al., 1989). La miotoxina II purificada del veneno de Bothrops asper es una proteína básica, dimérica con un monómero de peso molecular de 13,3kDa, que de acuerdo con la composición del aminoácido contiene una alta cantidad de residuos de aspartato y lisina como los de los aminoácidos hidrofóbicos (Lomonte et al., 1989). Dos fosfolipasas A2 miotóxicas básicas fueron purificadas del homogenato del veneno de Bothrops godmani de Costa Rica, con pesos moleculares de 14,3 kDa (miotoxina I) y 13,4 kDa (miotoxina II), que se comportan como proteínas anfifilicas y tienen composición de aminoácidos similares (Díaz et al., 1992).
Del efecto y acciones del veneno, los bothrópicos muestran actividades diferentes sobre diversos substratos tisulares, provocando una variedad de lesiones, tales como: hemorragias, desórdenes neuromusculares y destrucción de diversos tejidos (Rodríguez-Acosta et al., 1995).
Las proteínas y los péptidos biológicamente activos de los venenos de serpientes interaccionan con componentes del sistema hemostático humano, afectando la coagulación sanguínea, las células endoteliales y a las plaquetas (Markland F., 1998).
La actividad coagulante del tipo trombina produce fibrina a partir de fibrinógeno o por activación del factor X en presencia del calcio. La formación de trombos es casi instantánea en la vecindad del área de inoculación y en cierta forma bloquea la difusión del veneno por vía hemática; existe sin embargo, difusión linfática y formación de microtrombos de fibrina, especialmente en capilares pulmonares. El consumo de fibrinógeno puede producir coagulación intravascular diseminada con la aparición de hemorragias difusas (Toro et el., 1983).
