



Actividades
esterásicas y fosfolipásicas (hemolíticas y miotóxicas)
del veneno
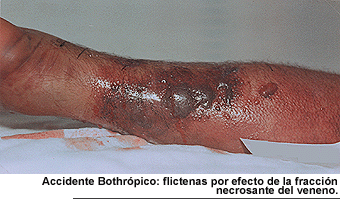
Las esterasas del veneno de serpiente no siempre inducen agregación plaquetaria y no activan ni destruyen los factores V y VIII por lo cual la heparina no es útil en estos casos. A ello se agrega la acción vascular directa de las hemorraginas, polipéptidos no enzimáticos que causan separación de las uniones endoteliales. El edema local observado en las mordeduras de Bothrops se debe a la acción proteolítica del mismo. Esta es producida por varias enzimas que actúan en substratos diferentes y se manifiestan en el paciente por dolor, edema, eritema, equimosis y flictenas en el sitio de la mordedura (Toro et al., 1983).
Componentes como la fosfolipasa A2 (PLA2), cataliza la hidrólisis de la cadena de Sn-2 acil de los fosfolípidos de membrana resultando la pérdida de la integridad y eventual muerte celular (Bortoleto et al., 1996).
Desde el punto de vista histopatológico, los venenos de muchas especies de serpientes causan daño en el tejido en el sitio de la inyección o mordedura y consisten en hemorragias, necrosis muscular y edema. En varios casos de envenenamiento puede producir perdida del tejido, incapacidad o amputación (Rucavado et al., 1996). El veneno perteneciente al genero Bothrops es el responsable del 90% de las mordeduras que ocurren en el Brasil las cuales afectan al mecanismo hemostático (Zaganelli et al., 1998).
Investigaciones efectuadas en varios países con el veneno del genero Bothrops (Gutierrez et al., 1980; Rodríguez-Acosta et al., 1993) han demostrado que causa un efecto local caracterizado por dolor, edema, equimosis, flictenas hemorrágicas y necrosis del tejido muscular. Los daños mencionados son producidos por algunos componentes del veneno como son las miotoxinas, que afectan a las fibras musculares, las hemorráginas que alteran la microvasculatura local y sistémica, así como otras sustancias que provocan edema con incremento de la presión tisular local. Aparte los venenos estudiados se pueden dividir en 3 grupos: Muy edematizante (B. Jararaca y B. jararacussu), medianamente edematizantes (B. Neuwiediidiporus y B. alternatus ) y con escasa actividad (Crotalus durissus terrifucus ). El veneno que mostró mayor actividad hemorrágica fue el de B. Neuwiedii deporus seguido de B. Jararacussu, B. Alternatus y jararaca, Crotalus durissus terrificus no produjo actividad hemorrágica.
El veneno de B. jararacussu provocó edema subcutáneo, necrosis fibrinoide de los vasos sanguíneos y áreas pequeñas de necrosis muscular. Con el veneno de B. jararaca se observó infiltrado inflamatorio, edema subcutáneo con micro-hemorrágias, dilatación de los vasos linfáticos y necrosis de los vasos sanguíneos.
El veneno de B. Neuwiedii deporus produjo edema leve y no se detectaron lesiones en los vasos sanguíneos; los venenos de B. alternatus y B. neuwiedii deporus causan edema y necrosis de las fibras musculares.
La trombocitina, una serina proteinasa aislada del veneno de Bothrops atrox causa agregación y secreción de las plaquetas. (Glusa, E et al 1991).
Orejuela et al 1991, encontraron edema local, hemorragias e hipotensión en casos humanos que sufrieron mordeduras por B. pictus y B. barnetti.
Estudios realizados en ratas con batroxobina del veneno mostró "in vitro" una actividad fibrinolitica y un efecto inhibitorio sobre la agregación plaquetaria. El desarrollo de la coagulopatia o hemorragia fue estudiado 2 horas después de la inyección con batroxobina y se encontró que la sangre era incoagulable con bajos niveles de fibrinogeno. La inyección de la hemorragina produjo daños severos al endotelio vascular, músculo esquelético y hemorragias en los riñones, pulmones e hígado (Kamiguti et al., 1991).
En humanos el veneno de la B. Jararaca causó síntomas locales, tales como: hinchamiento, equimosis y necrosis también desarrollaron manifestaciones sistemicas atribuibles a la actividad de la trombina, del factor X, de la protrombina activante de un componente de la agregación plaquetaria (Kamiguti et al., 1991 ).
Los efectos de una fosfolipasa A2 de Bothrops asper sobre las miofibrillas del músculo esquelético induce una necrosis después de la inyección intramuscular en el ratón. La secuencia de estos cambios fue hipercontracción con formación de masas densas alternados con espacios desprovistos de miofilamentos en el citoplasma. Esta etapa inicial es el resultado de la entrada de calcio después que la toxina induce daño al sarcoplasma. Un segundo cambio ocurre entre las 3 y 6 horas, aparecen " cambios hialinos " y los filamentos relajados tienen una distribución uniforme en el espacio intracélular. Finalmente, entre las 24, 48 y 72 horas, la degradación generalizada de proteínas miofibrilares probablemente causada por proteasas provenientes de células inflamatorias, tales como: neutrofilos y macrófagos que aumentan en número durante este periodo (Gutiérrez et al., 1990).

La actividad hemorrágica es causada por metaloproteínasas de veneno que degradan proteínas de la membrana basal en la pared de los vasos sanguíneos. Esta acción conduce a la pérdida de la integridad de los capilares con resultados hemorrágicos del sitio. Las toxinas hemorrágicas son metaloproteínasas, poseen un solo mol de zinc por molécula de proteínasa, son capaces de degradar proteínas de membrana basal incluyendo fibronectina, laminina y colágeno tipo IV degradando también gelatina y fibrinogeno. Bjarnason y Fox (1994) han dividido las metaloproteínasas hemorrágicas en tres clases basadas en el tamaño molecular de la proteínasa. En estudios de proteínas jararhagina C que se aísló y se caracterizó de veneno de Bothrops jararaca, contiene unos dominios semejantes a desintegrinas y rico en cisteina. Las jararhaginas C también inhiben agregación plaquetaria inducida por colágeno y ADP. Así, estas acciones de la jararhagina contribuye a estimular la vía fibrinolitica pueden también contribuir con el sistema hemorrágico observado en víctimas envenenadas con el veneno de Bothrops jararaca.
