



Las Metaloproteasas –
Desintegrinas en los venenos de las serpientes
Las Metaloproteasas – Desintegrinas, definen a una familia de proteínas
de los venenos de las serpientes que se caracterizan por su gran
afinidad de unión (Kd 10-7 ![]() 10-8 M) con las integrinas, activas como inactivas, alterando la función
plaquetaria (Huang, 1998). Las metaloproteasas de venenos de serpientes (SVMP´s)
forman junto con las ADAM´s, la subfamilia de las “Reprolisinas”
debido a que comparten la misma organización estructural de dominios,
aún cuando las ADAM´s posean otros dominios ausentes en las SVMP´s.
A su vez, la reprolisinas forman parte de la familia de las “Metzincinas”,
que se caracterizan por ser metaloproteasas dependientes de Zn+2, junto
con la metaloproteasas de matriz, las astacinas y las serralisinas, las cuales
presentan dominios de unión de Zn+2 similares con secuencias consenso
idénticas HEXXHXXGXXH y un residuo de “vuelta de metionina”
(Gutiérrez, 2000). Se organizan en forma de dominios estructurales según
el siguiente orden: a) un dominio pro-péptido N-terminal, b) un dominio
metaloproteasa, el cual digiere colágeno tipo IV, c) un dominio desintegrina
con las secuencias Arg-Gly-Asp (RGD) o Lys-Arg-Asp (KGD) y d) un dominio C-terminal
rico en cisteína (Wolfsberg y cols, 1995; Huang, 1998; Andrews, 2000).
Tales metaloproteasas encontradas en los venenos de serpientes poseen una longitud
aproximada de 200 residuos aminoacídicos y un sitio activo de unión
a Zn+2 con dominio HEXXH (Blobel y cols, 1992, Gutiérrez, 2000). Desde
el punto de vista genético, se ha encontrado que las SVMP´s se
encuentran codificadas por tres clases de cDNA: clase N-I, que codifica para
dominios pro y metaloproteasa, clase N-II que codifica para dominios pro y metaloproteasa
y tipo desintegrina y, clase N-III, que codifica para dominios pro y metaloproteasa,
tipo desintegrina y rico en cisterna localizado adyacentemente al extremo carboxi
terminal del dominio tipo desintegrina y la última de clase IV, que presenta
un dominio tipo lectina en el extremo carboxi terminal (Wolfsberg y cols, 1995;
McLane y cols, 1998; Yamamoto y cols, 1999). Resulta importante acotar que McLane,
(1998) y Gutiérrez (2000) se refieren a la clasificación de las
diferentes SVMP como de clases P-I, P-II, P-III y P-IV. McLane y cols, (1998),
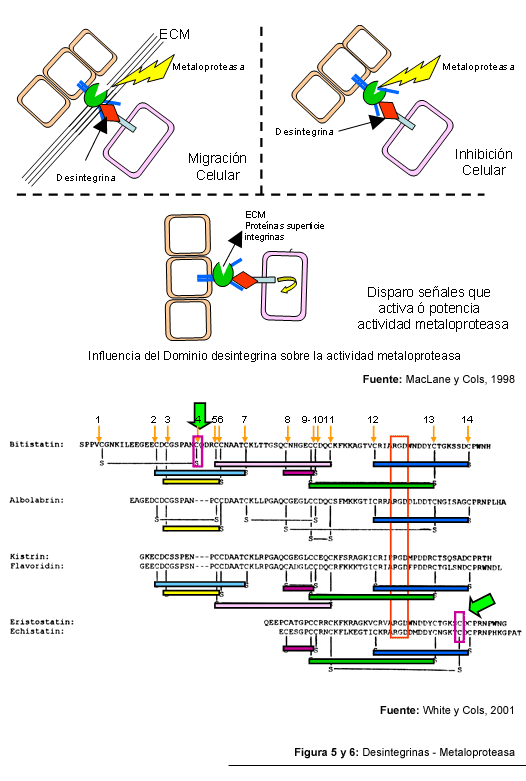
refiere que el dominio desintegrina de las SVMP´s, le confiere a estas
moléculas la capacidad para unirse al receptor (integrina) de la superficie
celular, potenciando de esta manera su capacidad proteolítica. Todos
los residuos de cisteína presentes en las SVMP´s se encuentran
enlazados formando puentes disulfuro (McLane y cols, 1998).
10-8 M) con las integrinas, activas como inactivas, alterando la función
plaquetaria (Huang, 1998). Las metaloproteasas de venenos de serpientes (SVMP´s)
forman junto con las ADAM´s, la subfamilia de las “Reprolisinas”
debido a que comparten la misma organización estructural de dominios,
aún cuando las ADAM´s posean otros dominios ausentes en las SVMP´s.
A su vez, la reprolisinas forman parte de la familia de las “Metzincinas”,
que se caracterizan por ser metaloproteasas dependientes de Zn+2, junto
con la metaloproteasas de matriz, las astacinas y las serralisinas, las cuales
presentan dominios de unión de Zn+2 similares con secuencias consenso
idénticas HEXXHXXGXXH y un residuo de “vuelta de metionina”
(Gutiérrez, 2000). Se organizan en forma de dominios estructurales según
el siguiente orden: a) un dominio pro-péptido N-terminal, b) un dominio
metaloproteasa, el cual digiere colágeno tipo IV, c) un dominio desintegrina
con las secuencias Arg-Gly-Asp (RGD) o Lys-Arg-Asp (KGD) y d) un dominio C-terminal
rico en cisteína (Wolfsberg y cols, 1995; Huang, 1998; Andrews, 2000).
Tales metaloproteasas encontradas en los venenos de serpientes poseen una longitud
aproximada de 200 residuos aminoacídicos y un sitio activo de unión
a Zn+2 con dominio HEXXH (Blobel y cols, 1992, Gutiérrez, 2000). Desde
el punto de vista genético, se ha encontrado que las SVMP´s se
encuentran codificadas por tres clases de cDNA: clase N-I, que codifica para
dominios pro y metaloproteasa, clase N-II que codifica para dominios pro y metaloproteasa
y tipo desintegrina y, clase N-III, que codifica para dominios pro y metaloproteasa,
tipo desintegrina y rico en cisterna localizado adyacentemente al extremo carboxi
terminal del dominio tipo desintegrina y la última de clase IV, que presenta
un dominio tipo lectina en el extremo carboxi terminal (Wolfsberg y cols, 1995;
McLane y cols, 1998; Yamamoto y cols, 1999). Resulta importante acotar que McLane,
(1998) y Gutiérrez (2000) se refieren a la clasificación de las
diferentes SVMP como de clases P-I, P-II, P-III y P-IV. McLane y cols, (1998),
refiere que el dominio desintegrina de las SVMP´s, le confiere a estas
moléculas la capacidad para unirse al receptor (integrina) de la superficie
celular, potenciando de esta manera su capacidad proteolítica. Todos
los residuos de cisteína presentes en las SVMP´s se encuentran
enlazados formando puentes disulfuro (McLane y cols, 1998).
Gutiérrez
(2000) refiere que las metaloproteasas son producidas como zimógenos,
en los cuales el mecanismo de “cysteine-switch” inhibe su actividad
enzimática. Los zimógenos serán procesados proteolíticamente
para ser activados. Su dominio de unión a Zn+2 es tetraédrico,
con la secuencia amino acídica referida anteriormente que contiene los
tres residuos de histidina y una molécula de agua. Adicionalmente, posee
un ión de calcio localizado sobre la superficie de la molécula,
del lado opuesto a la ranura del sitio activo, el cual parece ser importante
en su conformación estructural. La actividad hemorrágica se encuentra
asociada a su capacidad proteolítica. (Gutiérrez, 2000) también
refiere la existencia de metaloproteasas que carecen de actividad hemorrágica
y que son aquellas que presentan ambos dominios, desintegrina y metaloproteasa,
las que manifiestan mayor actividad hemorrágica que aquellas que solo
expresan el dominio metaloproteasa.
Las desintegrinas componen a una familia de inhibidores de la agregación
plaquetaria encontradas en los venenos de serpiente, además de poder
interactuar con las integrinas presentes en otras células, como fibroblastos
y osteoclastos y células de melanoma (Blobel y cols, 1992; McLane y cols,
1998). El termino desintegrina fue acuñado para describir a la interrupción
resultante de la interacción mediada por las integrinas con la matriz
extracelular. Los nombres de las desintegrinas aisladas a partir de los venenos
de serpiente son el producto de modificaciones hechas a sus respectivos géneros
(Gould y cols, 1990). Inicialmente se definieron como proteínas de bajo
peso molecular (49-84 amino ácidos), ricas en residuos de cisteína
que contienen un lazo RGD/KGD, que mantenido en una conformación apropiada
a través de puentes disulfuro, son capaces de actuar como fuertes inhibidores
de la agregación plaquetaria (McLane y cols, 1998). McLane (1998) también
refiere que, a través de estudios de resonancia magnética nuclear
(RMN), se ha determinado que la secuencia RGD se encuentra en el ápice
del lazo móvil, flanqueado por dos hojas ß
plegadas, el cual sobresale entre 14 y 17 Å del núcleo proteico.
Tal estructura terciaria le confiere una gran capacidad para producir cambios
conformacionales que dependen de la exposición del sitio de unión
dependiente de ligando en los receptores. Son péptidos cortos, no anclados
a la membrana celular (solubles), con gran afinidad a la glicoproteína
GPIIb-IIIa, presente en la membrana plaquetaria, capaces de inhibir la interacción
entre el fibrinógeno con la superficie de la plaqueta, inhibiendo de
esta manera la agregación plaquetaria (Blobel y cols, 1992). Su afinidad
por el receptor en cuestión, que es mayor que la del mismo ligando natural,
depende del tipo de desintegrina y el estado de activación del receptor.
Así por ejemplo, la eristostatina (Eristocophis macmahoni) es capaz de
unirse con la misma afinidad a plaquetas tanto activadas como en reposo, sin
embargo, la bitistatina (Bitis arietans), la echistatina (Echis carinatus) y
la albolabrina (Trimeresurus albolabris) muestran mucha mayor afinidad por las
plaquetas activadas por trombina o ADP que por las plaquetas en reposo (McLane
y cols, 1998). Gould (1990) propone como sistema de clasificación tres
subfamilias de desintegrinas: un primer grupo de desintegrinas cortas, con una
longitud de 48 o 49 residuos aminoacídicos, como por ejemplo la echistatina
y la eristostatina; un segundo grupo de desintegrinas medias con una longitud
de 70 a 73 residuos aminoacídicos, como por ejemplo la tigramina, la
albolabrina, la agkistrsotatina, la aplagina, la batroxostatina, y un tercer
grupo de desintegrinas largas, con una longitud de 83 u 84 residuos aminoacídicos,
como las bitistatinas (Gould y cols,1990; McLane y cols, 1998).
Gould (1990) también refiere que, de manera significativa, las regiones aminoacídicas con mayor variación se encuentran cercanos al dominio RGD y los residuos de cisteína cercanos a la región C- terminal.

En los tres subgrupos se observa la presencia de residuos aminoacídicos
bien conservados, según el cuadro siguiente:
Residuo |
Posición |
Cys* |
43,
48, 49, 52, 61, 73 y 80 |
Cys** |
17,
19, 25, 29, 30 y 35 |
Cys*** |
78 |
Arg-Gly
Asp (RGD) |
65
- 67 |
Gly |
46 |
Phe |
54 |
ASp |
70 |
Pro
|
81 |
Cys-Cys
(desintegrinas cortas) |
4
(8 residuos) |
Cys-Cys (desintegrinas medianas) |
6
(12 residuos) |
Cys-Cys
(desintegrinas largas) |
7
(14 residuos) |
|
-(*):
Posición de residuos de cisteína conservados en las tres
subfamilias de desintegrinas. -(**): Posición de residuos de cisteína conservados en subfamilias corta y media de desintegrinas. -(***): presente sólo en subfamilia de desintegrinas cortas. -La numeración se toma con referencia a las posiciones de cada residuo en la desintegrina de mayor longitud, la bististatina 3. |
En relación con las desintegrinas cortas, se citan como ejemplos la echistatitna
y la eristostatina, de naturaleza monomérica, un 62 % de homología
en su secuencia aminoacídica e idéntico patrón de puentes
disulfuro entre sus ocho residuos de cisteína. Sin embargo, estas desintegrinas
muestran diferencias funcionales significativas en sus interacciones con ciertas
integrinas. La eristostatina muestra alto grado de especificidad con la integrina
![]() IIbß3
(GPIIb-IIIa), mientras que las echistatina es capaz de reconocer a las integrinas
IIbß3
(GPIIb-IIIa), mientras que las echistatina es capaz de reconocer a las integrinas
![]() IIbß3,
IIbß3,
![]() Vß3
y
Vß3
y ![]() 5ß1
(McLane y cols, 1998). Tales diferencias funcionales pueden ser el resultado
de las diferencias a nivel estructural en el lazo del domino RGD, las cuales
se evidencian por la presencia de dos residuos hidrofóbicos de cadena
larga (Val25 y Trp30) alrededor del domino RGD en la eristostatina, lo cual
hace que el lazo sea de mayor anchura que en la echistatina, con residuos de
Arginina y Aspártico en las mismas posiciones (McLane y cols, 1998).
Por otro lado, se ha propuesto que el extremo C-terminal de la echistatina posee
actividad funcional separada de la del lazo RGD. Así por ejemplo, mientras
el lazo RGD determina el reconocimiento selectivo de las integrinas
5ß1
(McLane y cols, 1998). Tales diferencias funcionales pueden ser el resultado
de las diferencias a nivel estructural en el lazo del domino RGD, las cuales
se evidencian por la presencia de dos residuos hidrofóbicos de cadena
larga (Val25 y Trp30) alrededor del domino RGD en la eristostatina, lo cual
hace que el lazo sea de mayor anchura que en la echistatina, con residuos de
Arginina y Aspártico en las mismas posiciones (McLane y cols, 1998).
Por otro lado, se ha propuesto que el extremo C-terminal de la echistatina posee
actividad funcional separada de la del lazo RGD. Así por ejemplo, mientras
el lazo RGD determina el reconocimiento selectivo de las integrinas ![]() IIbß3,
IIbß3,
![]() Vß3
y
Vß3
y ![]() 5ß1,
el extremo C-terminal es capaz de unirse a integrinas no activadas, siendo esto
crucial para la expresión de los epítopes de los sitios de unión
dependientes de ligando (LIBS Ligang Induced Binding Sites) y los cambios conformacionales
del receptor, conllevando al aumento de la afinidad de unión y efecto
de la echsitatina (McLane y cols, 1998). De la misma forma, este autor refiere
que en el caso de las proteínas echistatina con secuencia ARGDDMP y eristotatina,
con secuencia ARGDWNP, si bien son ambas capaces de unirse a la
5ß1,
el extremo C-terminal es capaz de unirse a integrinas no activadas, siendo esto
crucial para la expresión de los epítopes de los sitios de unión
dependientes de ligando (LIBS Ligang Induced Binding Sites) y los cambios conformacionales
del receptor, conllevando al aumento de la afinidad de unión y efecto
de la echsitatina (McLane y cols, 1998). De la misma forma, este autor refiere
que en el caso de las proteínas echistatina con secuencia ARGDDMP y eristotatina,
con secuencia ARGDWNP, si bien son ambas capaces de unirse a la ![]() IIbß3
con diferentes afinidades, a través de estudio de competitividad, demostraron
que lo hacen sobre diferentes sitios en la integrina.
IIbß3
con diferentes afinidades, a través de estudio de competitividad, demostraron
que lo hacen sobre diferentes sitios en la integrina.
Por su parte, las desintegrinas de tamaño medio comparten una razonable
similitud de secuencia aminoacídica con las desintegrinas cortas, sin
embargo, el plegamiento del esqueleto peptídico (estructura secundaria)
y la estructura tridimensional (estructura terciaria) de la kistrina y la flavoridina
son diferentes a las encontradas en las desintegrinas cortas. Por ejemplo, aún
cuando siete de los ocho residuos de cisteína se encuentran conservados
entre ambos tipos de desintegrinas, existen diferencias significativas sus los
patrones de puente disulfuro (McLane y cols, 1998). De la misma manera como
ocurre con las desintegrinas de cadena corta, McLane (1998) refiere que en estudios
realizados con isoformas de la elegantita (Trimeresurus elegans), la secuencia
de residuos adyacentes al domino RGD son importantes en la determinación
de la selectividad de las integrinas. A través de estudios de competencia
por el mismo receptor, McLane (1998) también refiere que la elegantita
y la kistrina poseen diferentes sitios de unión sobre ![]() IIbß3,
tal y como se refirió para las desintegrinas de cadena corta.
IIbß3,
tal y como se refirió para las desintegrinas de cadena corta.
Finalmente, las desintegrinas de cadena larga, representada por la bitistatina, posee el mayor grado de homología con la secuencia del domino de tipo desintegrina algunas proteínas ADAM´s. El lazo RGD de la bitistatina y la eristostatina son casi idénticos, sin embargo la bitistatina resulta ser mucho menos inhibidora de la agregación plaquetaria que la eristostatina (McLane y cols, 1998). A diferencia del resto de la desintegrinas, la bitistatina posee dos residuos de cisteína bien conservados en las posiciones 5 y 24 formando un puente disulfuro. Tal puente disulfuro crea otro lazo adicional al lazo del dominio RGD, pero en posición opuesta o casi paralela a este último. La bitistatina también es capaz de inducir la proliferación de células endoteliales de aorta de bovino, en contraste con las kristrina y la echistatina, que inhiben tal función, interacción que tal vez ocurra a través de su extremo N-terminal (McLane y cols, 1998).

Además
de estos tres tipos de desintegrinas, clasificados según la longitud
de su estructura primaria, también existe otro grupo de desintegrinas
en venenos de serpiente: las desintegrinas diméricas, cuyo peso molecular
oscila entre 13 y 15 kDa, con pesos moleculares individuales de aproximadamente
7 kDa, pudiendo ser del tipo homo o heterodiméricas (McLane y cols, 1998).
Entre algunas de las desintegrinas diméricas se cita la contortrostatina
aislada a partir de Agkistrodon contortrix contortrix la cual es capaz de inhibir
la metástasis en células de melanoma por bloqueo de la integrina
![]() 5ß1,
mientras que las desintegrinas monoméricas son capaces de inhibir la
agregación plaquetaria y la fosforilación de residuos de Tyr,
se ha demostrado que la contortrostatina es capaz de inducir la fosforilación
de residuos de Tyr, aún cuando inhiben la agregación plaquetaria
(McLane y cols, 1998). Otros ejemplos citados por McLane y cols, (1998) incluyen
a la EMF10, heterodímero (subunidades A y B) aislado a partir del veneno
de la serpiente Eristocophis macmahoni, con 14,576 kDa y la EC3, aislada a partir
del veneno de la serpiente Echis carinatus , con un peso molecular de 14,761
kDa. Cuando se hacen estudios reduciendo las subunidaes de EC3, estas se caracterizan
por presentar un alto grado de homología en sus secuencias aminoacídicas
(residuos de Cys) al compararlas con las encontradas en otras desintegrinas.
McLane y cols, (1998), refiere que a diferencia de las desintegrinas que presentan
el dominio RGD, la EC3 presenta, en sustitución de esta región
en su subunidad A, la secuencia VGD, mientras que en la subunidad B, la sustitución
se presenta como MLD. Por otro lado,en la subunidad EM10A se presenta el domino
RGD, mientras que la EM10B se encuentra sustituida por la secuencia MGD (McLane
y cols, 1998).
5ß1,
mientras que las desintegrinas monoméricas son capaces de inhibir la
agregación plaquetaria y la fosforilación de residuos de Tyr,
se ha demostrado que la contortrostatina es capaz de inducir la fosforilación
de residuos de Tyr, aún cuando inhiben la agregación plaquetaria
(McLane y cols, 1998). Otros ejemplos citados por McLane y cols, (1998) incluyen
a la EMF10, heterodímero (subunidades A y B) aislado a partir del veneno
de la serpiente Eristocophis macmahoni, con 14,576 kDa y la EC3, aislada a partir
del veneno de la serpiente Echis carinatus , con un peso molecular de 14,761
kDa. Cuando se hacen estudios reduciendo las subunidaes de EC3, estas se caracterizan
por presentar un alto grado de homología en sus secuencias aminoacídicas
(residuos de Cys) al compararlas con las encontradas en otras desintegrinas.
McLane y cols, (1998), refiere que a diferencia de las desintegrinas que presentan
el dominio RGD, la EC3 presenta, en sustitución de esta región
en su subunidad A, la secuencia VGD, mientras que en la subunidad B, la sustitución
se presenta como MLD. Por otro lado,en la subunidad EM10A se presenta el domino
RGD, mientras que la EM10B se encuentra sustituida por la secuencia MGD (McLane
y cols, 1998).
Blobel (1992) refiere que en estudios realizados a proteínas aisladas de algunos venenos de serpiente, a través de resonancia magnética nuclear, se ha encontrado como característica más importante la presencia de un lazo (hairpin loop) en el cual se encuentra la secuencia RGD. Las regiones flanqueantes del lazo RGD se encuentran altamente conservadas, pudiendo llegar a ser críticas en su presentación del lazo. La alteración en esta secuencia afecta la afinidad o especificidad por el ligando, así por ejemplo, el cambio de la secuencia RGD por la secuencia KGD, en ciertas proteínas de venenos de serpiente, aumenta la afinidad por la glicoproteína GPIIb-IIIa, pero la inhabilita para unirse al receptor de vitronectina. Al menos, la mitad de los ligandos conocidos para las integrinas carecen del domino RGD y la presencia de esta secuencia en la mayoría de las desintegrinas aisladas a partir de los venenos de serpiente puede ser el reflejo del diseño experimental utilizado para su identificación, su interacción con GPIIb-IIIa (Blobel y cols, 1992). La configuración espacial del dominio RGD puede depender de las estructuras secundarias y terciarias de la molécula, lo cual está determinado por la formación apropiada de los puentes disulfuro, como lo refiere Gould (1990) al indicar que la alquilación o eliminación de estos lleva a la pérdida total de actividad de la proteína, fenómeno que se correlaciona con la teoría de que la unión de las proteínas adhesivas con las desintegrinas depende de la conformación de la secuencia RGD. Esto lleva a concluir que tanto la configuración espacial establecida por los puentes disulfuro y los tipos de residuos presentes en la región adyacente al domino RGD contribuyen a la gran capacidad de unión de las desintegrinas a sus ligandos en comparación con la afinidad que presentan péptidos lineales, en relación de nanomoles en contra de micromoles, respectivamente.
Otro aspecto interesante es la referencia que hace Blobel, (1992) acerca de las evidencias que sustentan la hipótesis de que las desintegrinas provienen de proteínas multifuncionales de mayor tamaño. El primer ejemplo de proteína multifuncional con el dominio desintegrina fue obtenida a partir del veneno de serpiente HBR1, aislada del veneno de Trimeresurus flavoviridis, la cual consta de 416 aminoácidos y además del dominio desintegrina, también presenta en su región amino terminal un dominio homólogo al de las metaloproteasas encontradas en los venenos de las serpientes y otro dominio, en este caso carboxi terminal rico en cisteína (Blobel y cols, 1992). A través de ensayos de clonación y secuenciación de los genes que codifican para los precursores de ciertas desintegrinas como la kistina (Calloselama rhodostoma), la tigramina (Trimeresurus gramineus) y la atrolisina (Crotalus atrox) han arrojado evidencias, con base en su estructura, de la presencia de una secuencia señal, seguida de una pequeña secuencia de función desconocida, un dominio metaloproteasa y un dominio desintegrina. En los tres ejemplos, el codón de terminación se localiza justo después del domino desintegrina (Blobel y cols, 1992). Debido a estas evidencias sustentadas por la estructura de los dominios de las proteínas precursoras se ha propuesto que las metaloproteasas y desintegrinas cortas encontradas en los venenos de las serpientes son procesadas proteolíticamente a partir de una proteína precursora de mayor tamaño (Blobel y cols, 1992). Por lo tanto la proteína HBR1, mencionada anteriormente, puede representar un intermediario del procesamiento de la proteína precursora o una proteína que no pudo ser procesada hidrolíticamente, debido tal vez a la carencia del sitio de ruptura apropiado o la proteasa adecuada (Blobel y cols, 1992). Gould (1990) refiere que además de las fracciones anteriormente mencionadas, existen otros productos aislados a partir de los venenos de serpiente que han sido identificados como de bajo peso molecular (5400 – 9000 d), con dominios RGD y rico en residuos de cisteína y capaces de unirse con gran afinidad a las integrinas de la superficie de las plaquetas y otras células, como por ejemplo la bitistatina 3 (Bitis arietans), la aplagina (Agkistrodon piscivorus piscivorus), la albolabrina y la elegantita, y la flavoridina (Trimeresurus flavoridis).
Con base en ensayos experimentales, Gould (1990) refiere que, sobre bases de comparación molar, las concentraciones de péptidos aislados de venenos de serpiente necesarios para lograr la IC50 de agregación plaquetaria en suspensión de células en plasma rico en plaquetas inducidas por ADP era entre 3000 y 30.000 veces más pequeñas que las requeridas por péptidos que contenían la secuencia RGD. El mismo autor refiere que, después de haber comparado las secuencias de amino ácidos de 14 péptidos aislados de venenos de serpiente, esta secuencia (RGD) es el sitio de reconocimiento de estos péptidos sobre la célula. Sin embargo, la potencia inhibitoria de estas moléculas sobre la interacción integrina ligando es una función, tanto de la conformación de la secuencia del domino RGD como de la secuencia que lo flanquea. Debido a que las secuencias que flanquean al dominio RGD, encontrado en péptidos de pequeño tamaño contribuyen a la especificidad de las integrinas, los residuos no conservados dentro de péptidos derivados de los venenos de serpiente pueden entonces contribuir a la selectividad de integrina.
Andrews
(2000) también hace referencia al hecho de que a través de estudios
de secuencias primarias de ADNc se ha determinado que esta familia de proteínas
deriva de un precursor de mayor tamaño, localizado hacia la región
N-terminal, el cual puede corresponder a la familia de las Lectinas Tipo C.
De manera interesante, muchas de las proteínas que afectan la función
plaquetaria pertenecen a una de las dos familias de proteínas conocidas
como familia de las Lectinas Tipo C y la familia de las Metaloproteasas –
Desintegrinas. Una de sus características más resaltantes es que
proteínas con formas estructuralmente relacionadas pueden presentar efectos
opuestos, mientras que proteínas estructuralmente diferentes pueden presentar
funciones relacionadas (Andrews, 2000).
McLane (1998), hace referencia a que al detallar la secuencia amino acídica
de los lazos tanto de las desintegrinas, hemorraginas y ADAM´s, se observan
variaciones en la composición de residuos básicos, ácidos
e hidrofóbicos manteniéndose conservados los residuos de cisteína.
Una desintegrina típica presenta su lazo de 11 aminoácidos flanqueados
por dos residuos de cisteína, la mayoría expresa la secuencia
RGD, mientras que otras como la EC3A, EC3B, EMF10B y la atrolisina expresan
las secuencias KGD, VGD, MLD, MGD y MVD, respectivamente. Los lazos de desintegrina
encontrados en ADAM´s y en las hemorraginas presentan un residuo de cisteína
insertado adyacente el extremo C-terminal de la secuencia RGD. Son estas diferencias
las que hacen que las diferentes desintegrinas muestren diferentes afinidades
por diferentes receptores adhesivos, lo que determina la selectividad de tales
proteínas.
