![]()
Title
Metalloproteases - Disintegrins in the Ophidism field
Abstract
This review resumes different basic aspects of the protein family called Metalloproteases-Disintegrins
(ADAM´s: A Disintegrin and Metalloprotease ). Because the high extension
of the topic, in relationship with the multiple functions that they develop
in biological organisms, it could be so extents to make a total recompilation
of all aspects from this protein family where it is involved. However, it will
emphasize the snake venoms metalloproteases-disintegrins complex.
Key
words
integrins, disintegrins, metalloproteases, snake venom
Las
Integrinas
Se define
como integrina a la superfamilia de glicoproteínas de membrana que median
la adhesión de células con la matriz extracelular y células
entre si mismas, siendo consideradas como el mayor y más importante grupo
de receptores para proteínas de la matriz extracelular. El término
fue introducido para denotar que los receptores estaban compuestos por glicoproteínas
integrales de membranas envueltas en la asociación de la matriz con el
citoesqueleto. Son, entonces, responsables de proveer el nexo funcional entre
el ambiente extracelular y el citoesqueleto, factor que resulta fundamental
para los mecanismos de adhesión y migración celular y la propagación
de varios tipos de sistemas de señalización (Dzamba, 2001).
Todas la integrinas se encuentran estructuradas como heterodímeros asociados
de forma no covalente. Basándose en la similitud de secuencia, el sistema
de nomenclatura propuesto para la designación de las integrinas, categoriza
las subunidades individuales de cada heterodímero como ![]() y ß,
ambas del tipo transmembrana, cuyas combinaciones definen la propiedad adhesiva
y de señalización. La mayor parte de la proteína se encuentra
expuesta hacia el medio extracelular, mientras que el citoesqueleto de actina
y la maquinaria de señalización se encuentran asociados al pequeño
dominio citoplasmático. Ambas subunidades son diferentes con baja homología
en sus secuencias (Dzamba, 2001). Dzamba, (2001) también reporta, dentro
del grupo de los mamíferos, la existencia de al menos 18 subunidades
y ß,
ambas del tipo transmembrana, cuyas combinaciones definen la propiedad adhesiva
y de señalización. La mayor parte de la proteína se encuentra
expuesta hacia el medio extracelular, mientras que el citoesqueleto de actina
y la maquinaria de señalización se encuentran asociados al pequeño
dominio citoplasmático. Ambas subunidades son diferentes con baja homología
en sus secuencias (Dzamba, 2001). Dzamba, (2001) también reporta, dentro
del grupo de los mamíferos, la existencia de al menos 18 subunidades
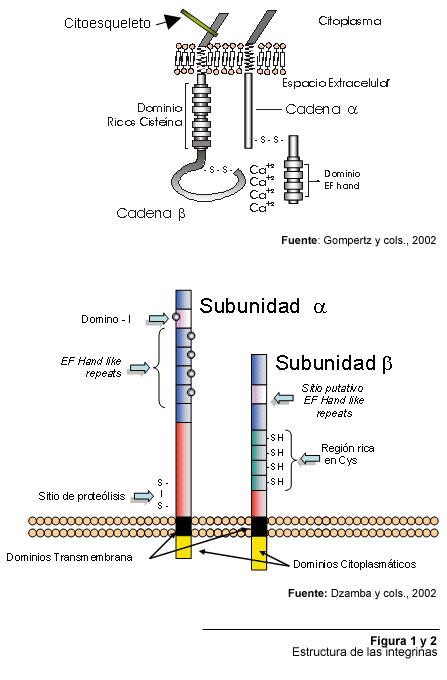
![]() y alrededor de 8 subunidades ß.
Las subunidades ß
contienen entre 760 y 790
residuos aminoacídicos mientras que las subunidades
y alrededor de 8 subunidades ß.
Las subunidades ß
contienen entre 760 y 790
residuos aminoacídicos mientras que las subunidades ![]() presentan tamaños de entre 1000 y 1200 residuos. Los dominios extracelulares
de las subunidades ß
presentan 56 residuos de cisteína, la mayoría de los cuales se
localizan dentro de un rango de 260 aminoácidos, separados de la membrana
plasmática por aproximadamente 50 residuos. Por su parte, las subunidades
presentan tamaños de entre 1000 y 1200 residuos. Los dominios extracelulares
de las subunidades ß
presentan 56 residuos de cisteína, la mayoría de los cuales se
localizan dentro de un rango de 260 aminoácidos, separados de la membrana
plasmática por aproximadamente 50 residuos. Por su parte, las subunidades
![]() contienen
siete secuencias repetitivas de aproximadamente 60 aminoácidos cada una,
que incluyen motivos EF HAND, con una secuencia consenso del tipo DxDxDGxxD,
capaces de atrapar cationes divalentes. Estos motivos son importantes para mantener
la capacidad de adhesión de la integrina y los cambios conformacionales
que afectan al receptor por el ligando (Dzamba, 2001). También se reporta
que la mitad de las subunidades
contienen
siete secuencias repetitivas de aproximadamente 60 aminoácidos cada una,
que incluyen motivos EF HAND, con una secuencia consenso del tipo DxDxDGxxD,
capaces de atrapar cationes divalentes. Estos motivos son importantes para mantener
la capacidad de adhesión de la integrina y los cambios conformacionales
que afectan al receptor por el ligando (Dzamba, 2001). También se reporta
que la mitad de las subunidades ![]() encontradas en las integrinas de mamíferos carecen del sitio de proteólisis
extracelular, pero contienen un dominio de inserción (I-Domain “Inserted
Domain”) cerca de la región N-terminal. Cada Dominio I está
constituído por una hoja beta rodeada por siete alfa hélices (Dzamba,
2001). Las figuras 1 y 2 proponen dos esquemas diferentes para descripción
de la estructura de las integrinas.
encontradas en las integrinas de mamíferos carecen del sitio de proteólisis
extracelular, pero contienen un dominio de inserción (I-Domain “Inserted
Domain”) cerca de la región N-terminal. Cada Dominio I está
constituído por una hoja beta rodeada por siete alfa hélices (Dzamba,
2001). Las figuras 1 y 2 proponen dos esquemas diferentes para descripción
de la estructura de las integrinas.
El principal
determinante de la especificidad de la interacción entre los ligandos
es la composición de las subunidades ![]() y ß
de cada tipo de molécula. Muchas de las integrinas
poseen la capacidad para reconocer la secuencia RGD presente en varios tipos
de proteína, pero esto no garantiza que dos proteínas que posean
esta secuencia puedan ser reconocidas por un mismo receptor. Esto ha llevado
a considerar la probabilidad de que sean la secuencias flanqueantes a la RGD
y las diferentes conformaciones tanto de los sitios adhesivos como de los bolsillos
de unión los que definan esta situación (Dzamba, 2001).
y ß
de cada tipo de molécula. Muchas de las integrinas
poseen la capacidad para reconocer la secuencia RGD presente en varios tipos
de proteína, pero esto no garantiza que dos proteínas que posean
esta secuencia puedan ser reconocidas por un mismo receptor. Esto ha llevado
a considerar la probabilidad de que sean la secuencias flanqueantes a la RGD
y las diferentes conformaciones tanto de los sitios adhesivos como de los bolsillos
de unión los que definan esta situación (Dzamba, 2001).
Otro factor es el relacionado con la existencia de diferentes estados de activación
de las integrinas, siendo definido el estado de activación como el cambio
en la afinidad por su ligando por un receptor individual. Al proceso regulatorio
capaz de modificar la afinidad, se define como Modulación de la Afinidad,
que es disparado a través de un sistema de señales del tipo “inside
out”, siendo entonces una forma rápida para regular las funciones
adhesivas en respuesta a varios estímulos fisiológicos (Dzamba,
2001). Ente los mecanismos involucrados en la regulación de la interacción
con el ligando se encuentra la presencia de iones metálicos , como lo
sugiere la existencia de los motivos EF – Hand y MIDAS (Metal Ion Dependent
Adhesión Sites), los cuales pueden modular positiva o negativamente.
Por ejemplo, el Mn+2 conlleva al aumento de la afinidad de receptor por su ligando,
mientras que Ca+2 estabiliza conformaciones de baja afinidad o estados de reposo.
Adicionalmente, se consideran los fenómenos de “clustering”
o agrupamiento de receptores como otra forma de aumentar la afinidad por su
ligando, el cual es independiente del estado de activación del receptor
mediado por cambios conformacionales. En este modelo, la presencia de ligandos
multivalentes o la asociación de receptores con el citoesqueleto pueden
limitar la difusión de la moléculas por la membrana incrementando
de esta manera la fuerza adhesiva de la interacción (Dzamba, 2001).
Las
funciones de las integrinas como mediadoras de adhesión y fusión
celular (célula – célula y célula – matriz),
por la activación e inhibición de señales, se lleva a cabo
a través de dos tipos de sistemas de señalización, uno
cuyo origen es la propia célula portadora de la integrina hacia el exterior
y otro que proviene del medio externo hacia la célula y que modula su
función. El primero se conoce como “inside – out signaling”
mientras que el segundo se conoce como “outside – in signaling”.
En el “inside – out signaling”, el aumento de afinidad de
los receptores, por cambios conformacionales, es mediada por la activación
previa de sistemas de señales intracelulares propios. Un ejemplo es el
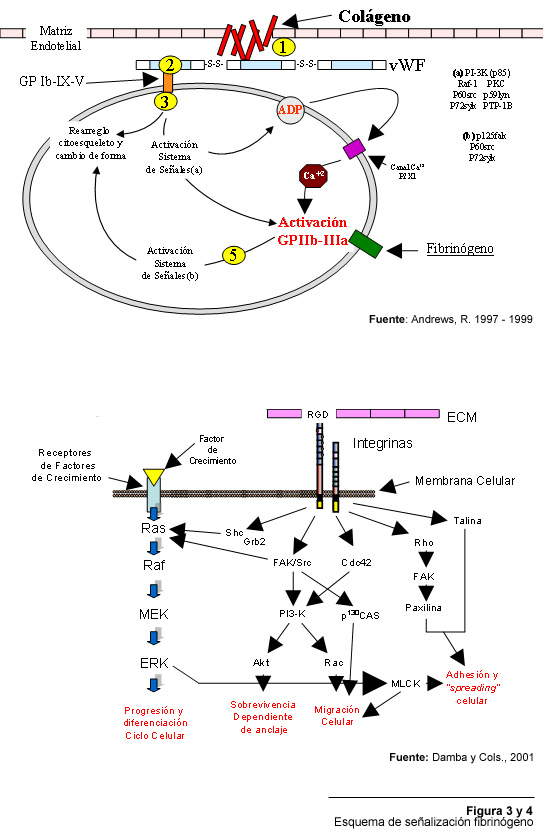
sistema de activación de la integrina GPIIb/IIIa, receptor del fibrinógeno
(Figura 3), en cual se encuentra en todo momento expuesto, pero es a través
de señales mediadas por la interacción de la plaqueta con ligandos
como el colágeno, el ADP y la trombina que la GPIIb/IIIa sufre el cambio
conformacional necesario para elevar su nivel de afinidad y desencadenar la
agregación plaquetaria (Dzamba, 2001). El segundo sistema de señales
“outside – in signaling”, se dispara al ocurrir la interacción
de la célula con alguno de sus ligandos para mediar la adhesión
la matriz extracelular influenciando de esta manera eventos como el ciclo de
división celular, cambios en la expresión génica, migración
celular y rearreglo del citoesqueleto (Figura 4) (Dzamba, 2001).
Se ve entonces la importancia de las integrinas como moléculas responsables
de numerosos procesos fisiológicos en donde resulta vital el contacto
directo entre las células intervinientes, sirviendo no solo como molécula
puente para interacción intercelular, sino también como molécula
puente ente la matriz extracelular y el citoesqueleto de la célula, a
través de la cual se intercambian señales celulares.