



Efectos de las desintegrinas de los venenos de las serpientes
sobre la agregación plaquetaria
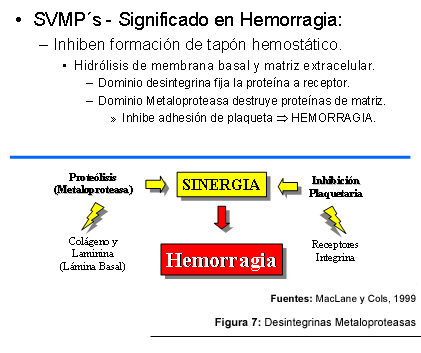
El sangrado es una de las manifestaciones más agresivas encontradas en víctimas de un accidente por serpientes de la familia Viperidae. Este efecto hemorrágico puede estar siendo causado por la proteólisis del colágeno y la laminina, componentes de la lámina basal de la microvasculatura. En estos pacientes, las proteínas ADAM pueden ser las responsables de promover un efecto sinergístico, ocurriendo la degradación de la membrana basal de los capilares por la región metaloproteasa y la inhibición de la función plaquetaria debida a la acción de las desintegrinas (Wolfsberg y cols, 1995, Huang, 1998).
Dentro de los sistemas de trombosis y hemostasia, la activación de la GPIIb-IIIa (integrina ?IIb?3) se produce a través de un sistema de señalización intracelular activado por la unión del vWF subendotelial al complejo de la GPIb-IX-V sobre la superficie plaquetaria, de forma tal que la activación de GPIIb-IIIa permite su unión al fibrinógeno o al vWF mediando de esta forma la agregación plaquetaria (Andrews, 2000). Por esta razón, las proteínas de venenos de serpiente con dominio RGD son capaces de afectar la función plaquetaria, siendo capaces de mimetizar los ligandos naturales de los receptores en la plaqueta, induciendo su activación o por el contrario sirviendo como inhibidores, evitando que estos ligandos naturales se unan a su receptor. Andrews, (2000), refiere la existencia de ciertas proteínas (Jararhagina-C de Bothrops jararaca y Atrolisina de Crotalus atrox) que a pesar de actuar como si fuesen desintegrinas (desintegrin-like) carecen de la secuencia típica RGD, inhibiendo la agregación plaquetaria dependiente de GPIIb-IIIa.
Existen venenos de serpiente pertenecientes a esta familia capaz de inducir la activación del vWF. Por ejemplo, la Botrocetina de una sola cadena aislada a partir del veneno de la serpiente Bothrops jararaca (Viperidae – Crotalineae), la cual posee un peso de aproximadamente 30 kDa reducida y no reducida, compuesta únicamente por los dominios desintegrina en su extremo N-terminal y el rico en cisteina C-terminal. Esta proteína también se caracteriza por la ausencia de la secuencia RGD en su dominio desintegrina (Andrews, 2000). Además de la Jararhagina-C de Bothrops jararaca, existen otras formas caracterizadas, una por la presencia de los dominios bcd llamada Jararhagina y la otra, la Jaracetina compuesta por dos dominios cd, [cd]2, unidas a través de un puente disulfuro entre los dominios (c). Estas proteínas activan al vWF uniéndose en su dominio de unión de integrina A1, induciendo su unión a la GPIb-IX-V (Andrews, 2000).
Además del efecto activador sobre el vWF, existen proteínas de esta familia capaces de romper a la GPIb-IX-V y al vWF. A partir de la descripción hecha de las desintegrinas mencionadas en los ejemplos anteriores, se puede deducir que el efecto proteolítico se encuentra ausente en la jaracetina y la botrocetina de una cadena, como parte de sus mecanismos de acción, debido a la ausencia del domino (b) correspondiente a la región metaloproteasa. Este no es el caso de las fracciones correspondientes a esta familia, derivadas de los venenos de cobras (Elapidae), las cuales inhiben la función plaquetaria al evitar la unión del vWF al GPIb-IX-V, debido a la proteólisis dependiente del catión divalente de cualquiera de los elementos involucrados, el ligando o el receptor (Andrews, 2000). Así por ejemplo, el autor refiere a la Mocarhagina, aislada a partir del veneno de la serpiente Naja mocambique mocambique (Elapidae), con un peso de aproximadamente 55 kDa, , la cual bloquea la agregación plaquetaria dependiente de vWF al romper a GPIb?, dominio de unión del factor (Andrews, 2000). Otro ejemplo de la actividad metaloproteasa de esta familia de proteínas es la Kaouthiagina, aislada del veneno de la serpiente Naja kaouthia (Elapidae), la cual también afecta la agregación dependiente del vWF, pero esta vez por manifestar su efecto proteolítico sobre el dominio A1 del vWF, del cual depende la unión con GPIb-IX-V (Andrews, 2000).
Finalmente,
(Huang, 1998; Andrews, 2000), refieren otro efecto mediado por las metaloproteasa
- desintegrina a través del bloqueo de la activación inducido
por el colágeno y su receptor, la integrina ?2?1 (GPIa-IIa). De esta
manera, tanto la Jararhagina (bcd ) y la Jaracetina [cd]2 inhiben la adhesión
plaquetaria dependiente del colágeno mediada por la integrina ?2?1 actuando
sobre el receptor, mientras que la Catrocollastatina, aislada a partir del veneno
de Crotalus atrox (Viperidae – Crotalineae) inhibe la función plaquetaria
dependiente del colágeno a través de un mecanismo que involucra
la interacción de este con su dominio tipo desintegrina.
