

Oxido Nítrico y ejercicio
Gran cantidad de evidencia clínica y patológica ha demostrado
que el ejercicio físico regular es capaz de producir una reducción
de las enfermedades cardiovasculares, tales como ateroesclerosis, enfermedad
coronaria, hipertensión arterial e hiperlipidemia (Peters y col., 1983;
Blair y col., 1995; Blair y col., 1996). Se ha demostrado un incremento del
diámetro coronario después del entrenamiento físico regular
(Heath y col, 1983), sugiriendo que un programa de ejercicio periódico
puede reducir la resistencia vascular. De hecho, el ejercicio regular ha mostrado
tener ese efecto tanto en pacientes hipertensos (Mannarino y col., 1989) como
en individuos sanos (Ekelund y col, 1988; Jungersten y col., 1996). Sin embargo,
el mecanismo por el cual se obtiene estos efectos no está totalmente
dilucidado.
En el sistema
cardiovascular del mamífero, el endotelio presenta respuestas singulares
a las fuerzas del flujo sanguíneo; el flujo pulsátil y el estrés
de roce son estímulos fisiológicos responsables en parte de la
liberación basal de NO (Schul, 1995). Ambos eventos se producen durante
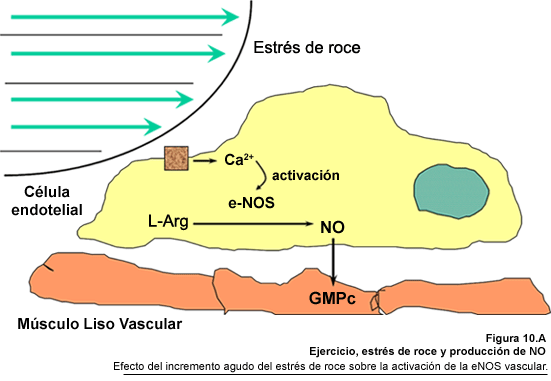
el ejercicio físico y son proporcionales a la intensidad del mismo (Fig.
10.A). El endotelio está localizado entre el flujo sanguíneo
y la pared vascular. Las células que recubren la circulación arterial
están expuestas a fuerzas hemodinámicas de mayor magnitud que
cualquier otro tejido de mamífero. En consecuencia, las respuestas mecánicas
reguladas por el endotelio han evolucionado mucho más notablemente en
relación con el control del tono vascular; como resultado los mecanismos
responsables para la transmisión y la transducción de la información
hemodinámica, desde la sangre hasta la musculatura lisa de la pared vascular
residen en el endotelio. Las fuerzas hemodinámicas también juegan
un papel importante en algunas patologías vasculares, particularmente
en la localización de lesiones de arteriosclerosis y en la hipertensión
arterial (Suarez-Munguia, 2000).
Los factores
hemodinámicos (definidos como fuerzas mecánicas del flujo sanguíneo)
afectan la biología endotelial, tanto por la acción directa del
estrés por roce y la deformación por presión, así
como por la modificación indirecta de la concentración de químicos
y agonistas en la superficie endotelial, alterando la interacción de
estas moléculas con sus receptores endoteliales. En realidad estos dos
mecanismos no son excluyentes uno del otro, ya que las fuerzas hemodinámicas
al actuar en forma directa sobre las enzimas de superficie o los receptores,
podrían modificar la interacción enzima-sustrato y agonista-receptor,
así como también cambiar la concentración de superficie
de los agonistas (Suárez-Munguia, 2000). El estrés sobre la célula
endotelial, puede, entre otras cosas activar o estimular la síntesis
de NOS; debemos recordar que la enzima endotelial (eNOS) tiene una característica
única, que consiste en un sitio de miristilación. Este sitio permite
el anclaje de la enzima a la membrana plasmática, facilitando la activación
de la eNOS por el estrés de roce que se produce, por ejemplo, durante
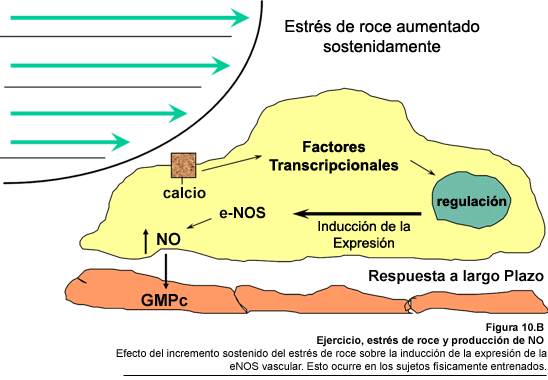
el ejercicio físico (Shul, 1995). En relación a esto, se ha demostrado
que la exposición a estrés de roce aumentado por períodos
de 3 h, es capaz de incrementar la cantidad de mRNA para eNOS, así como
la expresión de la proteína en células endoteliales de
aorta de bovino y en células endoteliales de aorta humana (Uematsu y
col., 1995), indicando que aunque dicha enzima eNOS está expresada en
forma constitutiva, puede estimularse por acción de estímulos
exógenos, tales como un aumento en las fuerzas mecánicas de roce
(Fig. 10.B) (Schul, 1995). Aún si las variaciones en
la síntesis de la enzima pueden ser modestas, pueden desempeñar
un papel fisiológico importante, pues hasta pequeños cambios en
la producción de NO pueden producir importantes cambios en las dimensiones
de los vasos. Bode-Boger y su grupo (1994) demostró que el ejercicio
físico produce un incremento en la cantidad de nitratos + nitritos y
de GMPc urinarios excretados por sujetos sanos, sugiriendo que dicho incremento
pudiera contribuir a la vasodilatación asociada al ejercicio. Estudios
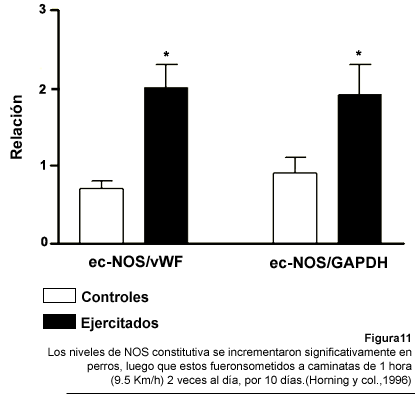
realizados tanto en animales como en humanos han demostrado que un programa
de ejercicios crónico incrementa la vasodilatación mediada por
endotelio o la cantidad de eNOS constitutiva (Delp y col., 1993; Shen y col.,
1995; Horning y col., 1996) (Fig. 11).
Como consecuencia
de la evidencia disponible, se esperaría que los niveles de metabolitos
del NO y de GMPc (segundo mensajero del NO) (Holzmann, 1982) estuvieran incrementados
en sujetos físicamente activos, en comparación con sujetos sedentarios,
reflejando así la mayor producción de NO endotelial a medida que
el nivel de entrenamiento cardiovascular fuese superior. Con la finalidad de
investigar la existencia de una relación entre la actividad física
sostenida y la formación sistémica de NO, nosotros cuantificamos
la excreción urinaria basal de nitratos + nitritos y del su segundo mensajero,
el GMPc en corredores, en sujetos sedentarios sanos y en pacientes con enfermedad
arterial coronaria (EAC) (Rodríguez-Plaza y col, 1997; Alfieri y col.,
2000); así mismo, evaluamos el efecto del ejercicio agudo en esas mismas
poblaciones.
En dicho
estudios se incluyeron un total de 44 sujetos masculinos. Todos los individuos
fueron entrevistados y completaron una encuesta que permitió incluirlos
en uno de los siguientes grupos: Grupo 1: Corredores altamente entrenados (90
Km/semana de trote). En la orina de estos sujetos se cuantificó a los
metabolitos del NO y al GMPc, antes y después de una carrera de 42.2
km. Grupo 2: Corredores entrenados (65 Km/semana de trote). En la orina de estos
sujetos se cuantificó a los metabolitos del NO y al GMPc, antes y después
de una carrera de 15 km. Grupo 3: Sujetos sedentarios sanos que no practicaban
ninguna actividad física regular durante su tiempo libre, ni como parte
de su trabajo. En la orina de estos sujetos se cuantificó a los metabolitos
del NO y al GMPc, en condiciones basales (una sola muestra). Grupo 4: Pacientes
con enfermedad arterial coronaria (EAC) comprobada (infarto de miocardio, angiografía
coronaria con obstrucción >50% en por lo menos una arteria coronaria
mayor). En estos pacientes se cuantificó metabolitos del NO y GMPc urinarios,
antes y después de una caminata supervisada de 3-6 Km. Esta cuantificación
se repitió después de que dichos pacientes siguieron un programa
de rehabilitación cardiaca de 12 semanas de duración.
Programa
de la rehabilitación cardiaca
Los pacientes con EAC (Grupo 4) fueron sometidos a un programa ambulatorio de
Rehabilitación Cardiaca de 12 semanas de duración (3 sesiones
semanales de ejercicio, de 1 hora de duración, a un 75-80% de su capacidad
máxima, para un total de 36 sesiones). Adicionalmente y con asesoramiento
cardiológico y nutricional permanente, todos los pacientes fueron animados
a ejercitarse fuera del programa formal y a seguir ajustes dietéticos
para lograr el peso ideal.
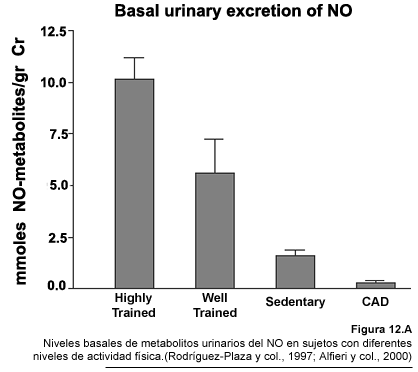
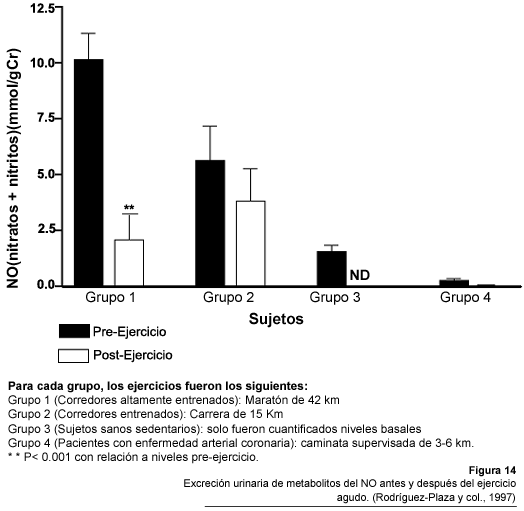
Los resultados de estos estudios permitieron demostrar que los niveles de nitratos
+ nitritos urinarios son mayores en los sujetos mas entrenados (Fig.12A)
(Fig.12B) (Rodríguez-Plaza y col., 1997). Sin embargo,
al cuantificar los niveles de GMPc, se observaron niveles urinarios basales
similares en los tres grupos de sujetos, independientemente de su nivel de entrenamiento
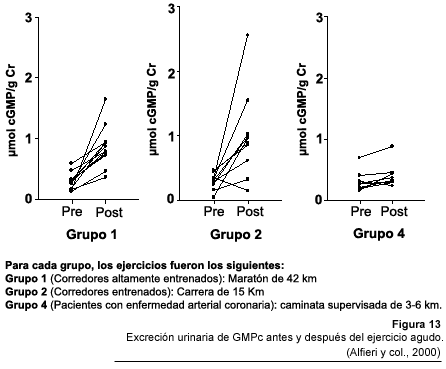
(Fig. 13) (Alfieri y col., 2000). Estos resultados concuerdan
con estudios previos de Poveda quien no encontró ninguna diferencia en
el GMPc plasmático basal entre atletas e individuos sedentarios, a pesar
de que el NO plasmático basal de los atletas duplicaba al de los sujetos
sanos que no practicaba ningún deporte (Poveda y col., 1997). Desde un
punto de vista práctico, estos resultados sugieren que los niveles del
GMPc basales no reflejan el nivel de salud cardiovascular asociada al ejercicio
crónico, a pesar que la excreción urinaria de metabolitos del
NO se relacionó directamente con la capacidad aeróbica máxima.
Las diferencias de comportamiento obtenidas entre los niveles basales de nitratos
+ nitritos y del GMPc urinarios, puede relacionarse con las diferencias en la
vida media de ambas substancias.

También
pudimos demostrar que el ejercicio agudo aumenta las concentraciones del GMPc
en sujetos sanos y en los pacientes con EAC. Estos aumentos en el GMPc urinario
fueron máximos a los 30-60 min. después de la realización
del ejercicio, seguida por un retorno rápido a los niveles pre-ejercicio
(Fig. 14) (Alfieri y col., 2000). Adicionalmente, demostramos
que la magnitud del aumento de los metabolitos del NO y del GMPc urinario inducido
en los pacientes EAC por la caminata supervisada, se incrementó después
de la realización del programa de rehabilitación cardiaca de 12
semanas, indicando que el ejercicio crónico juega un papel fundamental
en la cantidad de NO y de GMPc producido durante el ejercicio agudo (Fig. 15)
(Rodriguez-Plaza y col, 1997; Alfieri y col., 2000). Estos resultados pueden
contribuir a dar una explicación parcial de la acción beneficiosa
del ejercicio sobre la salud cardiovascular, reportada repetidamente por diversos
grupos de investigadores (Blair y col., 1995; Peters y col., 1983).



![]()








