Title
Nitric Oxide: studies
about its role in physiological and physiophatological functions
Abstract
Nitric oxide (NO) is a unique molecule, with neurotransmitter properties and
with many and important functions in the organism. It is synthesized from
L-arginina, producing also a molecule of L-citrulina, in a reaction catalyzed
by nitric oxide sinthase (NOS), of which there are 3 known isoenzimes: two
constitutives (cNOS) and one inducible (iNOS). The production of the iNOS
is regulated by their expression in the cells, whereas the cNOS is regulated
by its activity. As a consequence of its gaseous nature, NO diffuses rapidly
(it is not stored); it has very short half-life and for this reason its direct
quantification is very difficult.
NO is involved in many physiological
effects when it is produced in low quantities; also, when is generated in
high concentration, it plays an important role in citotoxicity and inflammation.
These aspects are reviewed and discussed in this article, along with original
contribution of our group, including studies about the role of NO in blood
pressure control, diabetes mellitus and neurogenic inflammation.
Key
words
Nitric oxide, endothelium,
diabetes, neurogenic inflammation.
Introducción
El
Óxido Nítrico
Hace apenas 20 años hubiera sido difícil aceptar la hipótesis
de que un gas tóxico ejerciera importantes funciones como mediador del
metabolismo celular. Sin embargo, en la actualidad dicho concepto es una realidad,
y el óxido nítrico (NO) se ha convertido en el protagonista de
un área de creciente interés para fisiólogos, farmacólogos
y neuroquímicos, entre otros, generándose sólo en el año
2002, unas 9000 publicaciones científicas. El NO es una molécula
única, con las características propias de un neurotransmisor;
tiene actividad vasodilatadora, estimulante de la síntesis de músculo
liso vascular, antiagregante plaquetario, y está involucrado en la génesis
de enfermedades como hipertensión, shock séptico, inflamación
y demencia, entre otras (Vallance y Collier, 1994; Court y col., 2002).
Aunque el
impacto sobre el conocimiento de la naturaleza y las propiedades del NO ha avanzado
aceleradamente en las últimas década, el inicio real de la historia
se remonta al siglo anterior, cuando compuestos como la nitroglicerina eran
utilizados para el tratamiento de la angina de pecho. Aunque los científicos
del siglo XIX sabían que la nitroglicerina era un explosivo potente,
desconocían por completo lo que la convertía en un tratamiento
eficaz para la angina; se aceptaba que de alguna forma, relajaba al músculo
liso vascular, permitiendo que los vasos se dilataran y pudiera llegar un mayor
flujo de sangre al corazón.
Pasaron
más de 100 años y una apasionante serie de experimentos se inicia
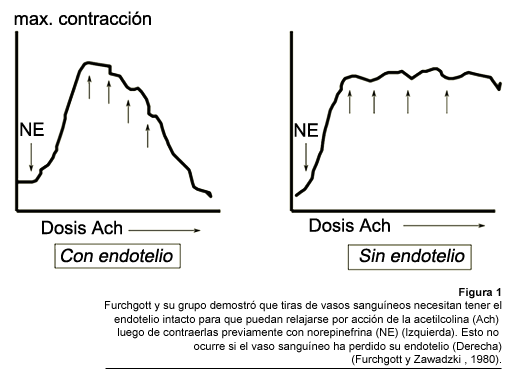
simultáneamente en varios laboratorios. En 1980, Furchgott y Zawadzki
descubrieron que el endotelio desempeña un papel crucial en la respuesta
vasodilatadora producida por acetilcolina (ACh), demostrando que la misma no
actúa directamente, sino que promueve la liberación de otra sustancia,
denominada por ellos como "factor relajador derivado de endotelio"
o FRDE. Aunque Furchgott sabía que el FRDE existía, no pudo aislarlo
ni identificarlo. El descubrimiento del FRDE hizo que las investigaciones aumentaran
súbitamente, con la contribución de numerosos grupos en todo el
mundo trabajando en la búsqueda de la identidad de este factor.
Los experimentos
decisivos que permitieron identificar al FRDE como NO fueron llevados a cabo
de forma independiente por Ignarro, en la Universidad de Los Ángeles,
por Furchgott en la Universidad del Estado de Nueva York y por Salvador Moncada
en los Laboratorios Wellcome Research, en Inglaterra. Los tres investigadores
descubrieron que tanto el NO como el FRDE compartían características
comunes que apuntaban a una única identidad. En una conferencia científica,
en julio de 1986, Ignarro y Furchgott presentaron de forma independiente sus
resultados ante una audiencia escéptica, publicándolos posteriormente
también por separado (Ignarro y col., 1987; Furchgott y col., 1987).
Pocos meses después, Moncada zanjó la discusión con un
importante artículo al que se ha hecho referencia frecuentemente, pues
en el mismo se demostró claramente que el NO era producido por células
endoteliales y que era sin dudas el FRDE (Palmer y col., 1987). En un comentario
adjunto al artículo de Moncada se describían estos hallazgos como
"la culminación de una de las sagas más interesantes en la
fisiología y farmacología vascular".
Esta serie
de resultados fue recibida con sorpresa en el campo biomédico, ya que
era difícil de aceptar que un gas tóxico tuviera funciones regulatorias
tan importantes; adicionalmente, en células de mamíferos no se
conocía ninguna vía bioquímica que resultara en la producción
de NO. Sin embargo, las evidencias experimentales fueron aclarando la situación;
para entender completamente cómo funcionaba el sistema, los científicos
aún tenían que demostrar la ruta de síntesis. La respuesta
llegó al poco tiempo, con experimentos realizados por Moncada y su grupo,
en células endoteliales vasculares, donde se demostró que el aminoácido
L-arginina es el precursor de la síntesis del NO (Moncada y col., 1989).
Síntesis
del Óxido Nítrico
Como ya se dijo, y debido a su naturaleza gaseosa, el NO tiene propiedades diferentes
a las de cualquier otro neurotransmisor; esta entidad química no puede
ser almacenada en el interior de vesículas para ser posteriormente exocitada.
En consecuencia, cuando una célula produce NO, éste escapa a través
de la membrana celular difundiendo a las proximidades. Esa misma propiedad de
atravesar las membranas permite al NO afectar a otras células sin necesidad
de receptores en la superficie. Se trata por tanto de una molécula-señal
que puede ser liberada desde cualquier parte de la neurona (donde se encuentre
la enzima de síntesis) y actuar sobre la misma célula que la produce
o cualquier célula en las proximidades, que pueda responder a ella.
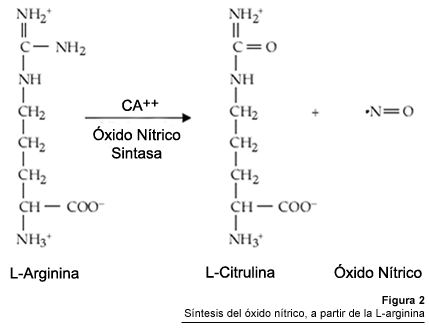
En la Figura
2 se muestra un esquema de la síntesis de NO. En dicha reacción
una molécula de L-arginina es transportada al interior de la célula
endotelial por un transportador específico, generándose una molécula
de L-citrulina y una molécula de NO; todo esto es catalizado por la enzima
sintasa del NO (NOS) (Schmidt y col, 1988). Para la síntesis del NO,
además del sustrato L-arginina, se requiere de la presencia de calmodulina
y de 4 cofactores: mononucleótido de flavina (FMN), dinucleótido
de flavin adenina (FAD), tetrahidrobiopterina (THB) y dinucleotido fosfato de
nicotinamida adenina (NADPH). Esta reacción puede ser inhibida por derivados
estructurales de la L-arginina, como la N-mono-metil-L-arginina (L-NMMA) y el
metilester de N-nitro-L-arginina (L-NAME), entre otros.
El NO, a
temperatura y presión atmosférica ambiente es un gas; y actúa
como un soluto no-cargado en la mayoría de los procesos biológicos
(Yun y col., 1996). Al tener un electrón desapareado, se comporta como
un radical libre y en consecuencia es muy reactivo; debido a esto tiene una
vida media de segundos, y es capaz de combinarse con rapidez a otros radicales
libres. Una vez liberado y ejercer sus efectos, se descompone para producir
dos metabolitos estables, los radicales nitrito y nitrato, en una reacción
que puede ser catalizada por metales de transición, incluyendo al hierro.

Sintasas
del Óxido Nítrico (NOS)
Debido a las características del NO, esta molécula no puede ser
almacenada; debido a esto, la regulación de la enzima que cataliza su
síntesis es muy importante; de hecho, la sintasa del NO (NOS) está
regulada más estrechamente que cualquier otra enzima en la vía
de síntesis de neurotransmisores.
Hasta el
momento, han sido identificadas tres isozimas de la NOS, constituidas por subunidades
homodiméricas con pesos moleculares entre 125 y 155 Kda (Knowles y Moncada,
1994). Las tres isoformas están codificadas en tres genes, localizados
en tres cromosomas diferentes. La nomenclatura de las NOS se ha prestado a confusión;
actualmente se utiliza la aceptada por la Unión Internacional de Farmacólogos
(IUPHAR, en inglés) (Moncada y col, 1997), la cual se resume en la Tabla
1.
Nomenclatura
Numérica |
Nomenclatura
Descriptiva |
Características |
| NOS1 |
c-NOS (constitutiva
o regulada por Calcio b-NOS
(de cerebro)
bc-NOS(constitutiva cerebral)
n-NOS (neuronal)
cn-NOS (constitutiva neuronal) |
- Se expresa constitutivamente
- Su actividad está regulada por calcio.
- Prototipo presente en neuronas
- Produce cantidades bajas (pmol) de NO, que cumple funciones señalización
celular.
|
| NOS2 |
i-NOS (inducible)
mac-NOS (de macrófagos)
hep-NOS (de hepatocitos)
|
- Es inducida por
citocinas
- Su actividad es independiente de calcio.
- Prototipo presente en macrófagos de murinos. - - Produce cantidades
altas (µmol) de NO que cumple funciones citotóxicas, citostáticas
o citoprotectoras.
|
| NOS3 |
c-NOS (constitutiva
o dependiente de calcio.
Esta nomenclatura de superpone con la NOS1).
e-NOS (endotelial)
ec-NOS (endotelial constitutiva) |
- Se expresa constitutivamente
- Su actividad está regulada por calcio.
- Prototipo presente en neuronas
- Produce cantidades bajas (pmol) de NO, que cumple funciones señalización
celular.
|
Tabla
1:
Nomenclatura y características generales de las NOS.
(Moncada
y col., 1997). |
Las 3 isoformas reconocidas
son:
-
Dos
isoformas constitutivas (cNOS) ambas dependientes de calcio: la isoforma
endotelial (eNOS), también conocida como tipo III (NOS3) y la isoforma
neuronal (nNOS), también denominada tipo I (NOS1). Dichas isoformas
median la producción de NO en cantidades bajas y fisiológicas,
para actuar como señalizador molecular (Moncada y col., 1997).
-
Una
forma inducible (iNOS), independiente de calcio, también denominada
de tipo II (NOS2), cuya expresión puede ser inducida en diferentes
tipos de células, tales como macrófagos, hepatocitos, neutrófilos,
músculo liso y endotelio; dicha inducción se produce como
respuesta a diferentes estímulos inmunológicos tales como:
el interferón gamma (IFN-?), el factor de necrosis tumoral alfa (TNF-?)
y el lipopolisacárido bacteriano (LPS). Esta isoforma cataliza la
producción de gran cantidad de NO, que puede ser tóxico en
ciertas circunstancias o para ciertos grupos celulares (Moncada y col.,
1997).
Las tres
isoformas de la NOS contienen un dominio carboxi-terminal homólogo al
citocromo P450, con una flavina como grupo prostético, y un dominio amino
terminal con un grupo heme como grupo prostético. Estos dominios terminales
están conectados por un tercer dominio, que es afín a calmodulina.
La unión de la calmodulina a la NOS parece ser el "interruptor molecular"
que permite el flujo de electrones desde el dominio reductasa hacia el grupo
heme, permitiendo la transformación del O2 y L-arginina en NO y L-citrulina
(Kelly y col., 1996). Las isoformas constitutivas NOS1 (nNOS) y en la NOS3 (eNOS)
se encuentran inactivas hasta que aumenta el calcio intracelular. Por ejemplo,
en las células endoteliales, la ACh, la bradiquinina, el ADP o el estrés
de roce son capaces de iniciar la señal que incrementa el calcio celular,
el cual regula la unión de calmodulina a su dominio, iniciando la síntesis
de NO. Cuando la calmodulina se une a la enzima, los electrones donados por
el NAPDH fluyen desde el dominio reductasa hacia el dominio oxigenasa y son
aceptados por el citocromo C y otros aceptores de electrones.
En contraste,
en la isoforma inducible (NOS2, o independiente de calcio), la calmodulina permanece
fuertemente unida, aún a bajas concentraciones de calcio, actuando esencialmente
como una subunidad mas (Kelly y col., 1996). En este caso, los electrones donados
por el NADPH son transportados por el FAD y por FMN hacia el grupo heme. En
estas condiciones, la iNOS cataliza la producción de una mezcla de aniones
superóxido (O2-) y de NO en altas cantidades, produciendo peroxinitritos
(ONOO-), con capacidad para producir citotoxicidad. En ausencia de THB, la NOS
genera H2O2, O2- y NO (Ferrer y col., 1998; Moncada y col., 1997)
Se ha demostrado
que la NOS de macrófagos es inducible. Los macrófagos no estimulados
no tienen la enzima, pero la activación de la célula se acompaña
de la aparición irreversible de la enzima iNOS. Es decir, la producción
de la iNOS es regulada transcripcionalmente (presencia o ausencia); mientras
que la forma cNOS (presente, por ejemplo en endotelio vascular) es regulada
en relación con su actividad (siempre está presente, pero puede
estar mas o menos activa). Este programa de activación es el más
importante, pero no es el único. Se sabe que las células musculares
lisas también contienen pequeñas cantidades de iNOS. La activación
crónica de las células endoteliales puede incrementar la síntesis
de dicha isoforma e incrementar la síntesis total de NO (Gosgnach y col,
1999). Por ejemplo, este evento puede ocurrir durante el entrenamiento físico
crónico, donde el flujo sanguíneo elevado es un estímulo
frecuente que favorece la expresión de la cNOS endotelial.
La enzima
constitutiva endotelial (eNOS) tiene un sitio de miristilación, capaz
de unirse a un ácido graso. Esto le permite asociarse a la membrana lipídica
de las células, a diferencia de las otras isoformas, que no tienen este
brazo lipídico, y en consecuencia, son hidrosolubles y se encuentran
libres en el citoplasma. Se cree que la asociación de la eNOS a la membrana
facilita que el NO formado esté más cercano al exterior celular
y en consecuencia difunda más rápidamente hacia la sangre y hacia
el músculo liso adyacente (Gosgnach y col., 1999).
El NO sintetizado
por la vía constitutiva ejerce sus diferentes efectos mediante su interacción
con el centro heme de la guanilato ciclasa soluble; esta activación induce
un incremento del GMPc. La isoforma inducible de la NOS esta ausente de macrófagos
y hepatocitos, pero cuando estas células son activadas por citocinas,
la iNOS se expresa, produciendo grandes cantidades de NO que forma entidades
muy reactivas y capaces de inactivar enzimas que contienen metales de transición,
como ciertas enzimas mitocondriales (Vallance y Collier, 1994). Actualmente
la iNOS es considerada como parte del sistema inmune (Hibbs, 1991).
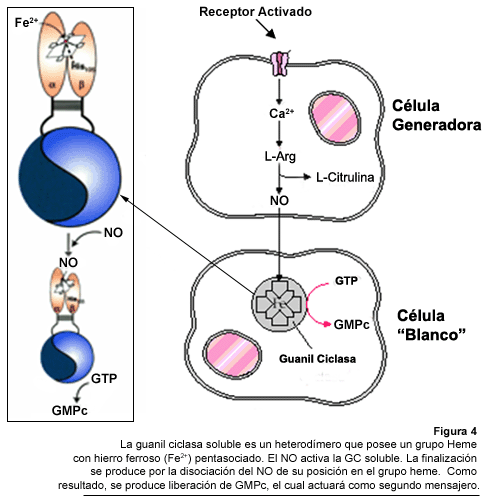
Blancos
moleculares del Óxido Nítrico
Como ya fue mencionado, el NO tiene muchos "blancos moleculares" o
sitios de unión. Es capaz de ligarse covalentemente al grupo heme de
diversas proteínas; interactúa con radicales libres para formar
peroxinitritos; interactúa con átomos de hierro o de cobre, presentes
en enzimas; se une a grupos tioles libres de varias proteínas y así
puede ser transportado. De todos esos sitios potenciales de unión del
NO, el más importante en el sistema cardiovascular es el grupo heme de
la guanilato ciclasa soluble. Dicha unión causa un desplazamiento alostérico
de grupos histidina y un cambio conformacional en la enzima, activándola
para producir GMPc (Michel, 1999).
Las células
musculares lisas contienen una fosfodiesterasa V, específica para el
GMPc. Esto activa a una protein kinasa dependiente de GMPc, llevando a la extrución
de calcio desde el citoplasma, por medio de una bomba calcio/magnesio ATPasa
y la consecuente relajación del músculo liso (Dusting, 1995).
Los medicamentos nitrovasodilatadores actúan de modo similar, ya que
son metabolizados a moléculas donadoras de NO, produciendo la serie de
eventos que producen vasodilatación (Dusting, 1995).
Inhibidores
de las Sintasas del Óxido Nítrico
Un punto clave para el descubrimiento de las funciones fisiológicas del
NO fue el hallazgo de que análogos de L-arginina actúan como inhibidores
específicos y competitivos de la NOS. El primer compuesto con estas características
a ser identificado fue un derivado metilado simple de dicho aminoácido,
la NG-monometil-L-arginina (L-NMMA), el cual fue inicialmente utilizado en estudios
de acciones citotóxicas de macrófagos activados, mucho antes de
que se descubriera que el NO participa en dicho proceso (Hibbs y col., 1990).
Ha sido descubierto un gran número de análogos de la L-arginina
que inhiben la actividad de la NOS, algunos con actividad irreversible o con
capacidad de inhibir tanto a la isoforma inducible como a la constitutiva; en
la Tabla 2 se muestran los mas representativos y comúnmente utilizados
(Moncada y col, 1991; Moncada y col., 1999).
Nombre |
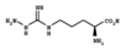
Abreviación |
Estructura |
Selectividad |
N
-monomethyl-L-arginine |
L-NMMA |
|
nNOS = Enos > iNOS
|
N
-nitro-L-arginine |
L-NA |
|
nNOS
= eNOS >> iNOS |
N
-amino-L-arginine |
L-NAA
|
|
nNOS
= iNOS > eNOS |
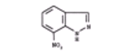
7-nitroindazole |
7-NI |
|
nNOS
= eNOS = iNOS |
N-
iminoethyl-L-omithine |
L-NIO |
|
iNOS
> eNOS = nNOS |
Aminoguanidine |
|
|
iNOS
> eNOS = nNOS |
Tabla
2: Diferentes Inhibidores de las isoformas
de la NOS. |
Cuantificación del NO en fluidos biológicos
Al ser el NO una molécula tan elusiva y que reacciona rápidamente
con otros elementos, su cuantificación directa en fluidos biológicos
no ha sido sencilla; se prefiere su cuantificación indirecta, lo cual
puede lograrse al medir sus metabolitos en orina o en plasma. Hoy en día
se acepta que prácticamente todos los nitratos y nitritos plasmáticos
y/o urinarios en el humano se derivan de la ruta L-arginina/NO (Rhodes y col.,
1995); sin embargo, para que esto sea cierto, deben tomarse las siguientes precauciones:
- restricción
dietética de fuentes exógenas de nitritos, como enlatados, derivados
cárnicos, embutidos, lechugas. Esto debe ser seguido por un mínimo
72 horas antes de la toma de la muestra.
- Ausencia
de infección bacteriana urinaria, ya que muchas bacterias pueden producir
nitritos como productos de su metabolismo. Esto debe constatarse mediante
un examen de orina
- Ausencia
de inflamación activa. Debe evitarse la cuantificación de nitratos
+ nitritos en sujetos con infecciones sistémicas, cuadros virales o
asmáticos.
Adicionalmente
y debido a que el GMPc es el mediador final de la producción del NO,
se ha determinado que su cuantificación podría considerarse, bajo
algunas circunstancias específicas, como otra forma de medición
indirecta de la producción del NO (Gosgnach y col., 1999).