

Oligonucleótidos formadores de triple hélices
La formación de una estructura compuesta de tres cadenas de ácido
desoxiribonucleíco o triple hélice (triplex ADN) fue descrita
por primera vez en 1957. Aunque en aquel momento se desconocían las
implicaciones de este descubrimiento, este ha dado lugar a un nuevo campo
de investigación de rápido crecimiento, enfocado al estudio
de las aplicaciones terapéuticas del triplex ADN. Durante los últimos
diez años, se ha logrado un enorme progreso en la optimización
de la formación de triplex ADN, así como en la caracterización
de estas moléculas. Dichos avances han contribuido al desarrollo de
aplicaciones tales como la mutagénesis sitio, especifica del ADN, y
la inhibición transcripcional de genes de relevancia clínica.
Las triples
hélices de ADN se forman cuando un oligonucleótido se une a una
región de homopurinas del ADN blanco. Los oligonucleótidos formadores
de triple hélices se unen de manera específica en la ranura mayor
de la doble hélice de ADN, formando enlaces de hidrógeno tipo
Hoogsteen o Hoogsteen reversos, con las bases de la cadena rica en purina. De
acuerdo a la composición de bases y la orientación con la que
se unen al ADN blanco, los oligonucleótidos pueden dar lugar a motivos
pirimidínicos o purínicos7, 8.
-
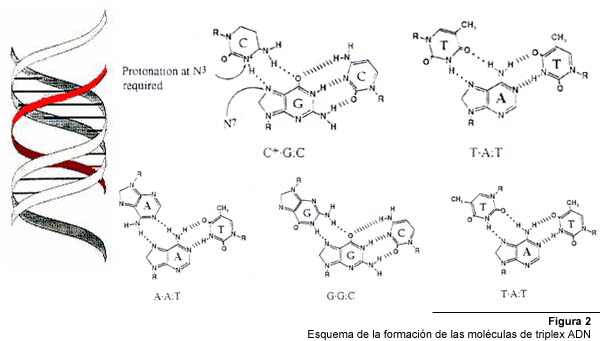
Los motivos pirimidínicos, se forman cuando un oligonucleótido
compuesto por citosina y timina se une de forma paralela a la cadena rica
en purinas del ADN, mediante enlaces Hoogsteen (Fig. 2). Las timinas (T)
de la tercera cadena se unen a la adenina (A) en el par A:T, mientras que
las citosinas protonadas (C+) se unen a la guanina (G) en el par C:G. Para
que se genere una triple hélice pirimidínica, se requiere
la protonación del N3 de las citosinas del oligonucleótido,
lo cual ocurre sólo a pH ácido, por que este tipo de enlace
no suele formarse en condiciones fisiológicas.
-
El
motivo purínico, en cambio, ocurre cuando un oligonucleótido
se une de manera anti-paralela a la cadena de homopurinas mediante enlaces
Hoogsteen reversos, y no requiere protonación de bases, por lo cual
es básicamente independiente del pH. En este tipo de configuración
se pueden formar tres tipos de enlaces: A de la tercera cadena puede unirse
a un par A:T, G puede unirse a un par G:C y T a uno A:T.
La formación
de moléculas de triple hélice de ADN es altamente específica,
pero no todas las secuencias de homopurinas se unen con la misma afinidad. Ciertas
evidencias sugieren que la formación de triplex purínicos estables
requiere que el oligonucleótido tenga un alto contenido de G (mas de
65%), mientras que en caso de los motivos pirimidínicos, la presencia
de largas secuencias continuas de citosinas protonadas tienden a desestabilizar
la formación del triplex. Tanto la longitud mínima requerida para
la formación de la triple hélice (típicamente de 8 a 14
nucleótidos), como los efectos desestabilizantes de las bases no apareadas
dependen en gran medida de las condiciones del experimento (temperatura, ambiente
iónico favorable o desfavorable, pH, concentración de oligonucleótido).
Las triples hélices son estabilizadas por cationes divalentes como el
Mg2+, Ca2+ y Zn2+, así como por poliaminas de origen natural como la
espermina, espermidina y putrescina, los cuales actúan reduciendo las
fuerzas electrostáticas repulsivas entre los fosfatos negativamente cargados
de las tres cadenas. La cinética de la formación de triple hélice
es aproximadamente dos órdenes de magnitud más lenta que la formación
del dúplex. Bajo condiciones en las cuales el oligonucleótido
esta en un exceso de 10 veces en relación a la cantidad de ADN blanco,
la saturación de un sitio de homopurina en un plásmido requiere
de más de ocho horas.
El uso de
triplex ADN como herramienta en medicina molecular esta sujeto a la solución
de algunos problemas que limitan actualmente su utilidad 15,19. Uno
de ellos tiene que ver con la dificultad de hallar en el genoma secuencias de
homopurinas lo suficientemente largas para formar triplex estables y la desestabilización
causada por la presencia de bases no apareadas. Otra dificultad que debe ser
superada en el caso de los motivos pirimidínicos, es la necesidad de
protonación de la citosina. Por otro lado, los oligonucleótidos
ricos en G tienen la tendencia a formar complejos intermoleculares en el motivo
purínico. Pero quizás los problemas más importantes son
aquellos inherentes al diseño de la terapia con oligonucleótidos,
como son el transporte del agente al interior de la célula, la tasa de
incorporación celular y su estabilidad.
Aún
así el potencial de uso de los oligonucleótidos formadores de
triplex es tan promisorio que varios grupos de investigación y compañías
de tecnología han enfocado sus esfuerzos a la solución de estos
problemas, desarrollando ingeniosas estrategias para superar los obstáculos19,
23. Por ejemplo, en relación a la compensación del efecto
desestabilizante de las bases no apareadas, se han diseñado análogos
con una menor sensibilidad al efecto disruptivo del desapareamiento, mediante
modelaje molecular. Asimismo, se han usado "linkers" sin bases (1,2-dideoxy-D-ribosa)
para "saltar" las bases no apareadas. En cuanto a la necesidad de
protonación de la citosina en los motivos pirimidínicos, este
puede ser solucionado mediante el uso de bases no naturales, las cuales mantienen
las propiedades de puentes de hidrogeno de la citosina, pero no requieren protonación,
como la 5-metilcitosina o 2'-O-methylpseudoisocytidina. En el caso de los motivos
purínicos, el mayor inconveniente es la inestabilidad del triplex en
presencia de concentraciones fisiológicas de cationes monovalentes, especialmente
K+ y Na+, lo cual podría explicarse por la formación de dímeros
y tetrámeros, o por el desplazamiento de cationes multivalentes más
estabilizantes como el Mg2+ y el Ca2+. Con la finalidad de evitar este fenómeno,
se han desarrollado análogos nucleotídicos, como el 7-deaza-2'deoxy-guanosina
o el 2'-deoxy-6-tioguanosina, que contrarrestan este problema. Otra opción
es reemplazar el esqueleto negativamente cargado del oligonucleótido
por una cargado positivamente, obviando la necesidad de las sustancias catiónicas.
Dentro de esta categoría destacan los oligonucleótidos fosforamidatos
(con enlaces N,N-Dietil-etilendiamino fosforamidatos) y los morfolino pirimidinos16,
ambos han sido estudiados con éxito. Finalmente, una alternativa valida
para mejorar la estabilidad de la formación de triplex, consiste en acoplar
a los oligonucleótidos, agentes inespecíficos de enlace a ADN.
En este sistema los oligonucleótidos aportan la especificidad al sistema,
mientras que el agente inespecífico contribuye a incrementar la estabilidad.
Entre los agentes de "anclaje" que están siendo probados se
encuentran agentes intercalantes como la acridina y el oxazolopiridocarbazol,
poliaminas como la espermidina, agentes fotoreactivos como el psoralen, y agentes
que estabilizan preferencialmente las triple hélices (en lugar de las
doble hélices) como la 2,6-aminoantraquinona o el BePI 27.
La mayor
parte de los trabajos de investigación realizados en los últimos
años en el área, tienen que ver con mejorar la estabilidad y el
transporte de los oligonucleótidos formadores de triplex al interior
celular 9,11. Las estrategias usadas incluyen el acoplamiento de
oligonucleótidos a policationes, tales como polilisina, el uso de conjugados
ADN-transferrina/polilisina en presencia de la cápside de adenovirus
de replicación deficiente, conjugación con péptidos fusogénicos,
el uso de receptores específicos como el del folato o transferrina, conjugación
a colesterol, y la más exitosa, la conjugación a lípidos
catiónicos. Recientemente, se publicó un trabajo elaborado por
Lewis et al., que reporta el uso de GS2888 citofectina para mejorar el transporte
de oligonucleótidos y ADN al interior de células mamíferas.
El compuesto es una formulación de un agente fusogénico con un
novedoso lípido catiónico que tiene una cadena alquil de longitud
optimizada. Este agente permite la transfección del ADN con alta eficiencia
y baja toxicidad, y que retiene su actividad en presencia de suero. Una opción
prometedora es la de generar los oligonucleótidos in vivo, eliminando
el problema de la inmunogenicidad, la absorción celular, la variación
de la dosis y el costo. Se ha propuesto utilizar un vector que permita la expresión
constitutiva de oligonucleótidos, en diferentes tipos de células.
Los oligonucleótidos
formadores de triple hélices tienen el potencial de funcionar como herramienta
para la manipulación de la expresión génica, a través
de su capacidad de unirse a un blanco de forma secuencia-especifica. Esta propiedad
ha sido usada en el diseño de varias estrategias de interferencia génica,
algunas de ellas de relevancia para aplicaciones clínicas. A continuación
haremos referencia a algunos de los ejemplos más interesantes en este
sentido 3,14.
-
Interferencia
sitio específica con proteínas de enlace a ADN. La estrategia
más directa para crear represores génicos artificiales, es
producir un complejo sitio-especifico que inhiba la unión de factores
de transcripción al promotor del gen blanco. Se ha demostrado que
la formación de triple hélices cerca del promotor inhibe la
unión de factores de trascripción tales como Spl, la T7 ARN
polimerasa, el factor nuclear a, y el receptor de la progesterona, inhibiendo
por lo tanto la transcripción. Esta estrategia ha sido utilizada
para inhibir selectivamente un amplio rango de genes de importancia clínica
in vitro: c-myc, Ha-ras, dihidrofolato reductasa, c-pim-l murino, HER2/neu
de rata, el factor de crecimiento epidermal humano, y el receptor de insulina
de ratón. Los oligonucleótidos formadores de triplex pueden
inhibir la trascripción de genes contenidos en construcciones transfectadas
en células mamíferas, como los promotores de los genes de
colágeno aI(I) y del receptor de andrógeno de rata, un gen
de respuesta a progesterona, el gen inducible del interferón, el
virus de la inmunodeficiencia humana, y el receptor de IL-2. Se ha demostrado
también que el tratamiento de la célula con oligonucleótidos
formadores de triplex puede dar lugar a la inhibición de la transcripción
de genes endógenos, como el de aldehido deshidrogenasa, el receptor
de IL-2, c-myc y el gen humano HER2/neu. En general, la inhibición
depende de la dosis de oligonucleótido y se han alcanzado niveles
de hasta 60% para algunos genes endógenos.
- "Tijeras
moleculares" para cortar genes. Una de las herramientas empleadas inicialmente
para estudiar la formación de triple hélices consistía
en acoplar los oligonucleótidos a Fe-EDTA, un agente que corta el ADN
en presencia de ditiotreitol. Estas "tijeras moleculares" han sido
modificadas para ser utilizadas en reacciones biológicamente relevantes,
como el mapeo de cromosomas. La necesidad de añadir un reactivo exógeno
para catalizar la escisión hace poco viable el uso de este compuesto
en células, pero otras opciones han sido estudiadas, y podrían
conducir eventualmente al uso de estas sustancias para terapias antivirales
y anticancerígenos.
- Abrazaderas
oligonucleotídicas o "clamps". Muchos virus tienen genomas
de cadenas sencillas de ADN o ARN, o atraviesan alguna forma de intermediario
de ADN de cadena sencilla durante la replicación. Esto los hace sustratos
ideales para agentes anti-replicativos tales como las abrazaderas oligonucleotídicas
o "clamps". Las abrazaderas oligonucleotídicas son moléculas
que se unen primero a una región de homopurinas u homopirímidinas
en una cadena sencilla de ADN, mediante los clásicos enlaces de Watson-Crick,
y luego se pliegan sobre si mismas para que el otro extremo de la molécula
forme una triple hélice. Estas estructuras son más estables
que las formadas por las cadenas individuales. Las abrazaderas oligonucleotídicas
pueden inhibir la elongación de la cadena durante la replicación
in vitro del ADN mediante las ADN polimerasas T7, Taq y Vent.
-
Mutagénesis
y recombinación. Uno de los usos potenciales de los oligonucleótidos
formadores de triplex, es su aplicación en el tratamiento de enfermedades
que resultan de mutaciones. En este sentido, los oligonucleótidos
pueden ser de utilidad para reemplazar los genes defectuosos con una copia
del gen silvestre, así como para detener o disminuir la expresión
de genes mutados, reparar genes mutados para producir proteínas funcionales
o suplementar de manera exógena el producto génico deseado.
Estos objetivos pueden alcanzarse a través de dos estrategias: mediante
mutagénesis sitio-dirigida, mediada por oligonucleótidos formadores
de triplex, o a través de la recombinación inducida por triplex.
En el primer caso, se aprovecha la especificidad derivada de la formación
de triplex para hacer llegar un mutágeno a un sitio específico
del ADN. Por ejemplo, se puede unir de manera covalente al oligonucleótido
una sustancia como el psoralen, el cual es un mutágeno fotoreactivo
bifuncional, que se intercala en el ADN y cuando es expuesto a radiación
UV genera un enlace covalente entre las timinas de ambas cadenas. De esta
manera, se pudieran reparar mutaciones puntuales o eliminar por completo
(knock-out) ciertas funciones génicas en las células. Por
otro lado, la inducción de recombinación mediante el uso de
oligonucleótidos formadores de triplex, permitiría reemplazar
fragmentos "grandes" de ADN. La recombinación homologa
es un proceso bastante ineficiente, pero puede ser favorecido introduciendo
cortes en las cadenas de ADN. Por lo tanto, el uso de oligonucleótidos
formadores de triplex para generar daño al ADN de manera sitio específico,
podría estimular potencialmente la recombinación homologa.




