Degradación de mARN por ribozimas secuencia-específicas
La regulación génica ocurre a varios niveles, incluyendo la
transcripción, la estabilidad del mARN, y la traducción. Otra
forma de controlar la expresión génica es hacer que un mARN
específico sea el blanco de la maquinaria de degradación. Una
vez que un gen ha sido transcrito a ARN, ocurren una serie de eventos de procesamiento
que llevan a la producción de un mARN maduro. La transferencia de información
desde el mARN a la proteína puede ser bloqueada por oligonucleótidos
anti-sentido o ribozimas. En 1982 varios laboratorios descubrieron que ciertas
reacciones de splicing de ARN eran catalizadas por enzimas compuestas de ARN
llamadas ribozimas. Las ribozimas incluyen los intrones del grupo I y grupo
II, la sub-unidad ARN de la ARNsa P, ribozimas de horquilla del virus de la
hepatitis delta, ribozimas ribosomales y ribozimas de cabeza de martillo (o
hammerhead). Las ribozimas, como los agentes anti-sentido, la acción
consiste en la formación de pares de bases complementarias, pero ellas
pueden también cortar el ARN blanco, dando lugar a su degradación.
La ribozima hammerhead, fue descubierta en viroides y esta involucrada en
el procesamiento de mensajes poli-cistrónicos. De forma natural actúa
en cis durante la replicación viral, pero se puede producir una ribozima
hammerhead que actúe en trans sobre otras moléculas de ARN.
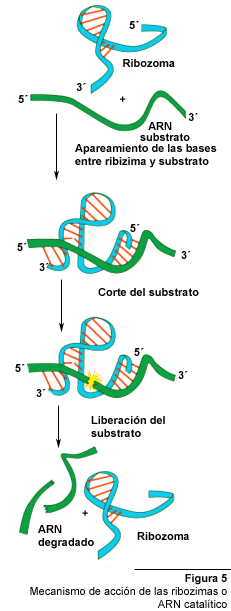
La ribozima hammerhead de acción trans consiste de secciones anti-sentido
(denominadas "tallos" I y III) y un dominio catalítico con
un tallo adyacente así como una sección en asa. La ribozima
y su sustrato hibridizan a través de los tallos I y III. En teoría
la ribozima hammerhead puede ser re-diseñada para cortar cualquier
mARN. La especificidad del corte y su eficiencia viene determinada por los
brazos de unión (tallos I y III). El corte es una reacción de
trans-esterificación, en la cual reacciona el extremo 5'-hidroxil y
el extremo 2',3'- fosfato cíclico en el sustrato nucleotídico.
Esta es una de las enzimas ARN más pequeñas conocidas y pudiera
tener utilidad en terapia génica, al cortar mARN que codifiquen genes
nocivos o esenciales para la supervivencia de ciertas células. Los
blancos potenciales para la degradación mediada por ribozimas incluyen
proteínas virales, reguladoras del ciclo celular, factores de trascripción
y proteínas de fusión aberrantes17.