

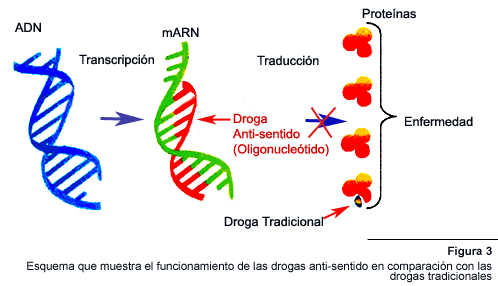
ARN Anti-sentido
La interferencia secuencia-especifica con la función del ARN, mediante
el uso de oligonucleótidos complementarios, fue propuesta por primera
vez hace más de dos décadas. La tecnología de oligonucleótido
anti-sentido utiliza moléculas de cadena sencilla de ARN o ADN para
modular el metabolismo del mARN. Es la especificidad de la interacción
de estos oligonucleótidos con las secuencias blanco, lo que hace que
al menos en teoría, los oligonucleótidos anti-sentido puedan
ser usados para atacar de forma específica un gen determinado. Varios
mecanismos parecen estar involucrados en la modulación de la expresión
génica mediada por oligonucleótidos anti-sentido28.
En primer lugar, los oligonucleótidos pueden unirse directamente al
mARN y obstruir físicamente su traducción. Otro mecanismo de
igual o mayor importancia parece ser la activación de la ARNasa H celular,
la cual corta de manera específica el mARN en el dúplex ARN-ADN.
Finalmente, el ARN anti-sentido puede también proveer el dúplex
ARN-ARN necesario para la digestión por ARNasa L, la cual corta de
manera preferencial ARN de cadena sencilla adyacente a dúplex de ARN.
Mediante una combinación de estos mecanismos de acción, se espera
que la tecnología anti-sentido pueda ser utilizada para inhibir no
sólo la traducción del mARN, sino también otros procesos
celulares esenciales que dependen del ARN, tales como la replicación.
Ciertos
oligonucleótidos del tipo fosfodiester, sin modificaciones ulteriores,
como los que ocurren en la naturaleza, han sido usados como drogas anti-sentido
tanto in vitro como in vivo. Sin embargo, estos son muy sensibles a las núcleasas
presentes en los fluidos biológicos, lo que limita su potencial terapéutico.
Por ello, se han estudiado una serie de análogos modificados del esqueleto
fosfodiester que incrementan la estabilidad de los oligonucleótidos.
Entre estas modificaciones destacan los oligonucleótidos fosforotioatos
(PS) y los oligonucleótidos metil fosfonates (MP), en los cuales uno
de los átomos de oxigeno que no forman enlaces, son sustituidos por un
grupo sulfuro o metilo, respectivamente.
Los oligonucleótidos
PS han sido usados para inhibir la traducción de mARN de células
mamíferas en cultivo. Los genes que han sido atacados incluyen bcl-2,
IL- 1, ICAM-1, cmyc, c-myb, c-mos, receptor de factor de crecimiento nervioso,
receptor IL-1, IL-2b, TGF-l y retinoblastoma-1. Los oligonucleótidos
PS, además de ser resistentes a las núcleasas, son substratos
de la ARNasa H, lo cual constituye una ventaja para su función, como
se explicó con anterioridad, y además pueden formar complejos
con el mARN blanco a 37ºC. Por esta razón, estos han sido estudiados
a nivel de modelos animales, y este tipo de drogas podrían ser de utilidad
en un futuro cercano para el tratamiento de infecciones virales.
Por otro
lado, los oligonucleótidos MP debido a su baja solubilidad, han sido
menos exitosos. Sin embargo, se ha demostrado que actúan de forma secuencia-especifica
contra el virus del herpes y suprimen la traducción de un alelo mutado
Ha-ras en fibroblastos NIH 3T3 transformados con ras, sin alterar el alelo silvestre.
También han sido usados para disminuir la traducción de c-myc
en un modelo animal.
La tecnología
anti-sentido, a pesar de ser exitosa en muchos casos, ha demostrado ser altamente
variable en su efectividad. Las causas se derivan probablemente de dos fuentes
principales: En primer lugar, para que un oligonucleótido anti-sentido
se una a su secuencia blanco, debe ser capaz primero de encontrar una secuencia
accesible. La accesibilidad de la secuencia blanco es al menos en parte función
de la estructura física del mARN, la cual a su vez esta determinada por
la composición interna de bases y las proteínas de la célula
asociadas al ARN. Dado que es casi imposible predecir la estructura secundaria
in vivo del ARN, el éxito de la tecnología anti-sentido
es en parte un asunto de "suerte". El otro gran obstáculo para
el uso de oligonucleótidos anti-sentido, al igual que sucede con los
oligonucleótidos formadores de triplex, es la habilidad de transportarlos
al interior celular, de forma que puedan interactuar con la secuencia blanco.
Los oligonucleótidos y sus derivados, son poli-aniones y como tales tienen
poca o ninguna capacidad de difundir a través de las membranas plasmáticas,
y son absorbidos por las células sólo a través de mecanismos
dependientes de energía. Se piensa que la endocitosis mediada por receptores
es el principal mecanismo de transporte de oligonucleótidos al interior
celular. Cómo se discutió anteriormente, en el caso de los oligonucleótidos
formadores de triplex, se han venido explorando una gran variedad de estrategias
para solventar los problemas de absorción celular de estos compuestos,
e incrementar la tasa a la cual atraviesan la membrana endosomal. Estas estrategias
incluyen: el acoplamiento de oligonucleótidos a poli-cationes tales como
la polilisina, el uso de conjugados ADN-transferrina/polilisina en presencia
de la cápside de un adenovirus de replicación deficiente, la conjugación
con péptidos fusogénicos, el uso de receptores específicos
como el del folato o de la transferrina, la conjugación a colesterol,
y la más exitosa que es la conjugación a lípidos cationicos.
Una interesante opción es utilizar el rARN como vehículo para
transportar otras actividades biológicas, tales como el ARN anti-sentido26.
Dado que el rARN es el ARN más abundante y estable en la célula,
y que entra en contacto con todos los mARN que han sido traducidos, constituiría
el vehículo ideal para favorecer la actividad de un ARN anti-sentido.




