

![]()
Sinapsis
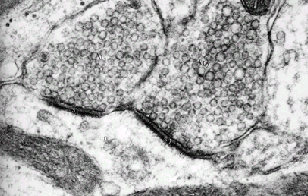 La sinapsis es la estructura
responsable de la transmisión química entre dos células a
nivel del sistema nervioso que ocurre por el mecanismo de
exocitosis . En la micrografía electrónica se puede observar un
terminal nervioso con los elementos presinápticos y
postsinápticos. Así se pueden apreciar las vesículas
presinápticas SSV, densidades presinápticas y una densidad
postsináptica divididas por un espacio sináptico de 15 a 100
nm. Las estructuras densas están dadas por la presencia de
diversas proteínas sinápticas. Ya se han caracterizado
múltiples proteínas asociadas con el proceso de exocitosis y
que se pueden diferenciar según el tipo de vesícula (ver
arriba) y también tipos celulares.
La sinapsis es la estructura
responsable de la transmisión química entre dos células a
nivel del sistema nervioso que ocurre por el mecanismo de
exocitosis . En la micrografía electrónica se puede observar un
terminal nervioso con los elementos presinápticos y
postsinápticos. Así se pueden apreciar las vesículas
presinápticas SSV, densidades presinápticas y una densidad
postsináptica divididas por un espacio sináptico de 15 a 100
nm. Las estructuras densas están dadas por la presencia de
diversas proteínas sinápticas. Ya se han caracterizado
múltiples proteínas asociadas con el proceso de exocitosis y
que se pueden diferenciar según el tipo de vesícula (ver
arriba) y también tipos celulares.
Las proteínas involucradas de una manera más universal en el proceso de exocitosis son las siguientes:
Proteínas de la membrana vesicular
Bomba de protones vacuolar
Es una ATPasa que al generar un gradiente electroquímico de protones genera la energía para la captura de los neurotransmisores (NTs). Componente mayoritario de las SSV.
Transportador de neurotransmisores
Proteínas con 12 dominios transmembrana. Varía según el tipo de NT clásico, no existe para NTs peptídicos.
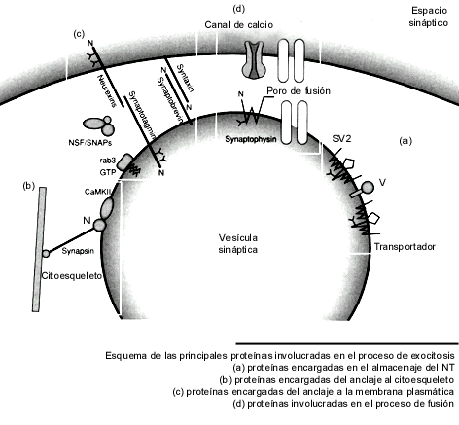
Se encarga de la recaptura del NT a nivel del terminal. Almacena al NT en altas concentraciones y puede llegar a 0.6 M, como en el caso de la acetycolina.
SV2 Proteína altamente glicosilada. Presenta homología con proteínas transportadoras de bacterias y eucariotes. Posible función de transporte de Cl- . Recientemente se ha encontrado que se une a sinaptotagmina.
Sinapsina Varios isoformas , se considera una ATPasa específica de neuronas. Fundamental para la unión de las SSV a proteínas del citoesqueleto como la actina. Tiene sitios de regulación por fosforilación para una kinasa de la Ca-calmodulina. Mantiene a las vesículas SSV en un almacén de reserva , listo para liberación, cerca de la zona activa de la sinapsis.
Proteinkinasa I y II dependientes de Ca2+-calmodulina (CaMKI y II). Fosforiliza la sinapsina y regula negativamente la unión de las SSV a la actina. Se encuentra asociada a la membrana vesicular y citoplasmática.
Sinaptotagminas Proteína con al menos 8 isoformas, presente en células eucarióticas superiores. Fundamental para el anclaje y posiblemente para la fusión de las vesículas a zonas activas de la membrana plasmática, por su unión con proteínas específicas de la membrana como la sintaxina y neurexinas. Puede formar parte del complejo de v-SNARE (receptores del complejo proteico SNAP) en vesículas sinápticas. Presenta 2 dominios de unión para Ca++ con una afinidad de 10 uM.
Sinaptobrevinas (VAMP) Proteínas cortas fundamental para el anclaje y posible fusión de las vesículas al unirse a proteínas específicas de la membrana plasmática como la sintaxina y la SNAP25, todas ellas son altamente conservadas desde levaduras hasta mamíferos. Son reguladas por Ca++. Estas proteínas forman parte de las denominadas proteínas v-SNARE. Son disociadas por las toxinas botulínica y tetánica.
Rab3 Son proteínas muy conservadas en la escala evolutiva desde las levaduras hasta los mamíferos. Es una GTPasa de peso molecular bajo regulada por GTP. Modulan el anclaje y posible activación de las vesículas a las zonas activas y la regulación de las proteínas SNARE. Se recicla de la membrana vesicular al citoplasma.
Sinaptofisinas Posible componente del poro de fusión. Se une a sinaptobrevina. Se encuentra altamente concentrada en vesículas SSV y muy poco en las LDCV. Se regula por fosforilación por PKII dependiente de Ca-calmodulina.
Proteínas solubles asociadas a la membrana plasmática
Factor sensible a N-etilmaleimide (NSF) Es una ATPasa fundamental para direccionar el trafico de membranas en todas las células eucariotas a diferentes niveles. De manera parecida se aislaron las Proteínas soluble unida a NSF (SNAP). Estas proteínas deben unirse para activar el proceso de dirección y anclaje de las vesículas además de otras proteínas especificas como las SNARE, los receptores del complejo proteico SNAP. En el terminal nervioso el complejo SNARE está formado por sintaxina, SNAP25 y sinaptobrevina. Diferentes toxinas botulínicas son capaces de disociar estas proteínas.
Sec6/8 Complejo de 8 proteínas , homólogo a complejos proteicos de las levaduras. Fundamentales en todos las células para el proceso de direccionar el tráfico de proteínas y vesículas. Se encuentra soluble y ligado a las membranas plasmáticas. Se une a la sintaxina y a la profilina del citoesqueleto
Munc18 Proteínas fundamentales en el proceso de anclaje de las vesículas se unen a las sintaxinas.
Proteínas de la zona activa de la membrana plasmática
Neurexinas Existen más de 1000 isoformas de esta familia. Se encuentran a nivel del terminal nervioso y tienen funciones de reconocimiento celular y de trafico de membranas y facilitan el anclaje especifico.
Sintaxinas Ampliamente distribuidas. Tienen función en el anclaje de las vesículas al unirse con sinaptotagnina, sinaptobrevina , SNAP25, Sec6/8 y canales de Ca++. Hidrolizadas por la toxina botulínica.
Canales de Ca++ voltaje sensibles Se ha demostrado la presencia de canales de Ca++ a nivel de las zonas activas de una sinapsis. Se han descrito diferentes tipos de canales de Ca++ asociados a la sinapsis (N,L,P/Q).
t-SNARE Son diversas proteínas de la membrana plasmática que actúan como receptores específicos para las proteínas homólogas de las vesículas como son la sinaptobrevina y la sinaptotagmina. Este tipo de proteínas se han encontrado también para dirigir el tráfico de membranas a nivel del aparato de Golgi y están altamente conservadas desde levaduras hasta los mamíferos. Se consideran elementos fundamentales en el proceso de anclaje y fusión de las vesículas.
![]()