Introducción
El receptor del factor de crecimiento epidérmico (EGFR, por epidermal growth factor receptor; también denominado ErbB1/HER1) pertenece a la superfamilia de receptores localizados en la membrana plasmática que presentan actividad tirosina quinasa intrínseca. En humanos, el gen que codifica el EGFR (c-erbB1) se encuentra en el brazo corto (región p13-p12) del cromosoma 7 (Tsui and Farrall, 1991). Este gen está compuesto por 28 exones que ocupan un segmento de 75 kb, apareciendo de forma aberrante o amplificado en muchos tumores malignos, como por ejemplo en gliomas y glioblastomas (Wong et al., 1992; Ekstrand et al., 1994), en diversos carcinomas (Merlino et al., 1984; Ullrich et al., 1984; Nishikawa et al., 1994; Kim and Muller, 1999) y algunos sarcomas (Yamamoto et al., 1983; Pelley et al., 1989). Este gen codifica a una proteína precursora de 1210 aminoácidos que posee una corta secuencia líder hidrofóbica en su extremo N-terminal que es usada para su inserción en la membrana, siendo posteriormente eliminada por procesamiento proteolítico (Ullrich et al., 1984). El receptor maduro es una glicoproteína integral de membrana de 170 kDa que está constituida por un dominio extracelular amino terminal, un único dominio transmembranal y un dominio citoplásmico carboxilo terminal en el que se localiza el sitio catalítico responsable de la actividad tirosina quinasa (Carpenter and Cohen, 1979; Carpenter, 1987; Hernández-Sotomayor and Carpenter, 1992; Wells, 1999).
Algo más de la mitad de la cadena polipeptídica del EGFR forma su dominio extracelular. Este dominio, que contiene múltiples residuos N-glicosilados ricos en manosa, presenta dos zonas en las que existen un gran número de residuos de cisteína, entre las que se encuentra el sitio de unión del ligando (Carpenter and Zendegui, 1986; Todderud and Carpenter, 1988; Lax et al., 1988, 1989). Este sitio es específicamente reconocido por una familia de factores de crecimiento que poseen módulos estructurales semejantes al del factor de crecimiento epidérmico (EGF), su ligando prototipo. Las cadenas glicosílicas del receptor parecen estar implicadas en el correcto plegamiento del mismo y en su transporte a la superficie celular (Soderquist and Carpenter, 1984; Slieker and Lane, 1985; Lane et al., 1985).
El dominio transmembranal, como otros segmentos proteicos helicoidales que atraviesan membranas biológicas, es rico en aminoácidos hidrofóbicos. Este dominio juega un papel fundamental en la transmisión de información a través de la membrana plasmática, ya que comunica el sitio de unión del ligando extracelular con el sitio catalítico tirosina quinasa intracelular (Yarden and Schlessinger, 1987; Schlessinger, 1988).
En el dominio citoplásmico del EGFR se encuentra localizado el sitio catalítico responsable de su actividad tirosina quinasa. Este sitio está altamente conservado entre los receptores tirosina quinasa y las diferentes tirosinas quinasas citoplásmicas que no son receptores (Hanks et al., 1988). En este dominio se encuentra un residuo de lisina (Lys721), que está implicado en la unión del ATP al receptor (Russo et al., 1985), y cinco residuos de tirosina (Tyr992, Tyr1068, Tyr1086, Tyr1148 y Tyr1173) en su extremo más distal, que son susceptibles de ser transfosforilados después de producirse la dimerización del receptor (Downward et al., 1984; Margolis et al., 1989; Walton et al., 1990). Los residuos de fosfotirosina así generados sirven como sitios de reclutamiento y anclaje de proteínas que contienen dominios SH2 (por Src homology domain 2) (Heldi, 1991; Koch et al., 1991; Margolis, 1992) o dominios PTB (por phospho-tyrosine-binding domains) (van der Geer and Pawson, 1995) que inician múltiples vías de señalización intracelular (ver Fig. 1).
Adicionalmente, se ha demostrado que la tirosina quinasa citoplásmica Src fosforila al EGFR en varios residuos de tirosina diferentes (Tyr820, Tyr845, Tyr891 y Tyr1101) (Sato et al., 1995; Stover et al., 1995; Biscardi et al., 1999; Tice et al., 1999). Estos residuos de fosfotirosina podrían ser también reconocidos por proteínas adaptadoras y transductoras que poseen dominios SH2 o dominios PTB, lo que explicaría el aumento de la señal mitogénica mediada por EGF en células que sobreexpresan Src (Stover et al., 1995; Tice et al., 1999). La región citoplásmica del EGFR posee además diferentes residuos de serina y treonina con función reguladora que son susceptibles de ser fosforilados por proteínas quinasas exógenas, lo que suele producir la inhibición de la actividad tirosina quinasa del receptor, como veremos más adelante.
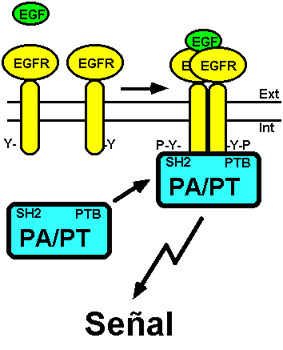
Figura 1. Activación del EGFR.
La unión del ligando (EGF) a su receptor (EGFR)
produce la dimerización de éste, la activación de su tirosina
quinasa y la transfosforilación de residuos de tirosina (-Y-P).
Proteínas adaptadoras (PA) o proteínas transductoras (PT)
se unen a los residuos de fosfotirosina del receptor activado
mediante sus dominios SH2 o PTB, transmitiendo señales al
interior celular. Para más detalles ver texto.
Agradecimiento
La
investigación realizada en el laboratorio de A.V. está
financiada por la Comisión Interministerial de Ciencia y
Tecnología (SAF99-0052), la Consejería de Educación de la
Comunidad de Madrid (08.5/0019/1997), la Agencia Española de
Cooperación Internacional (99CN0011) y el Ministerio de
Educación y Cultura (Programa de Cooperación Científica con
Iberoamérica). Los autores presentan sus disculpas a los colegas
cuyos trabajos originales no han sido citados por limitación de
espacio.
