La bomba de calcio (o Ca2+-ATPasa) de la
membrana plasmática se ha reconocido como la enzima
fundamental en la regulación de la concentración
citoplasmática basal de este catión. La Ca2+-ATPasa
de la membrana plasmática es estimulada por calmodulina
(CaM), su modulador proteico natural (Fig. 1),
fosfolípidos acídicos y ácidos grasos poli-insaturados
de cadena larga (15). También puede ser estimulada
mediante fosforilación por la protein-quinasa A y por la
protein-quinasa C. La proteólisis parcial de la enzima
simula el efecto de la CaM (1), lo cual ha permitido
elaborar un modelo mediante el cual la CaM removería una
compuerta auto-inhibitoria de la enzima permitiendo así
un mayor acceso de los sustratos (Ca2+ y ATP)
al sitio activo (2, 12, 13). 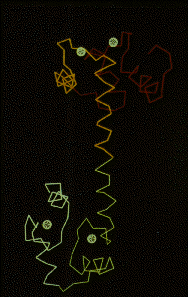
Estructura
tridimensional de la Calmodulina Se
puede observar los 4 dominios de union de calcio
y el alto contenido de estructura ahelices.
|

Modelo
de la estructura tridimensional de la calmodulina
(a) y de su interaccion con la quinasa de la
cadena ligera de la miosina.Se puede observar
como la calmodulina se pliega alrededor del sitio
de interaccion con la quinasa. Este modelo expone
la altisima flexibilidad de la calmodulina.
|
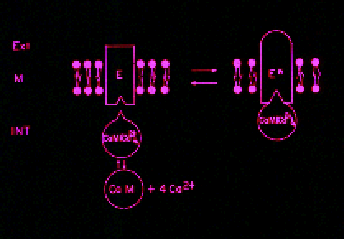
Fig.
1 Modelo de Interacción de la calmodulina con la
Ca2+-ATPasa en presencia
de Ca2+. El modelo
destaca que la interacción es directa, lo cual
permite la purificación de la enzima mediante
una columna de afinidad con calmodulina-agarosa.
|
La
actividad de la enzima también puede ser incrementada
mediante la auto-agregación de la enzima, lo cual
permite sugerir que la enzima podría presentar una
transición de monómero a dímero (20). Los solventes
orgánicos como el dimetilsulfóxido y los poli-alcoholes
también simulan el efecto estimulatorio de la CaM (3, 4,
6), lo cual sugiere que también actúan removiendo la
mencionada compuerta auto-inhibitoria
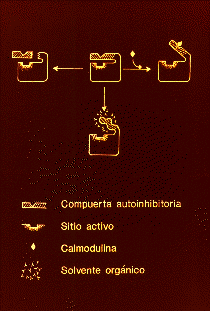
Fig 2. Modelo de Interacción de
distintos efectores sobre la Ca2+-ATPasa
de la membrana plasmática. El modelo muestra
de la remoción de la compuerta autoinhibitoria
mediante la unión de esta a diferentes ligandos
o mediante proteólisis parcial. En todos los
casos, la resultante es la misma: Un incremento
en la accesibilidad de los sustratos
|
Tomando en
cuenta que la interacción de la Ca2+-ATPasa
con la CaM es directa, la enzima puede ser purificada a
homogeneidad a partir de membranas asiladas de
eritrocitos humanos, solubilizadas con detergente,
mediante la utilización de una columna de afinidad de
calmodulina unida covalentemente a una matriz de agarosa
(1), de la cual se eluye al quelar el calcio del medio.
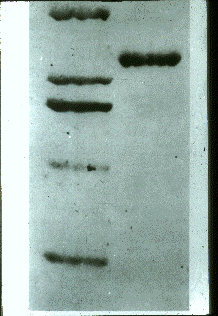
| Fig.
3 Electroforesis en gel de poliacrilamida del
producto de elución de la columna de afinidad de
calmodulina-agarosa luego de la quelación del Ca2+
con EGTA. El gel muestra una banda única de
140.000 Da., correspondiente a la Ca2+-ATPasa.
A la izquierda, las bandas corresponden a
patrones de peso molecular conocido. |
|




