



Nociones básicas
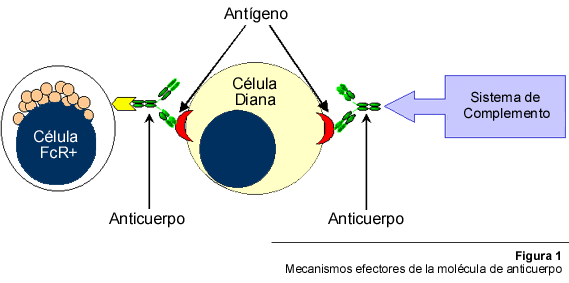
En el ámbito de la respuesta inmune específica de los organismos vertebrados, las inmunoglobulinas (Ig) o anticuerpos (Ac) juegan un papel central. Estas moléculas tienen la habilidad de reconocer específicamente y mediar la eliminación de sustancias y organismos extraños, tales como toxinas bacterianas y virus. Ello lo logran gracias a que, luego de ligar el antígeno (Ag), los Ac interactúan con receptores presentes en ciertas poblaciones celulares y con moléculas del sistema de complemento (Figura 1), conduciendo a la activación de mecanismos efectores, los cuales finalmente, son los responsables de la mencionada eliminación.
Consideraciones estructurales y funcionales
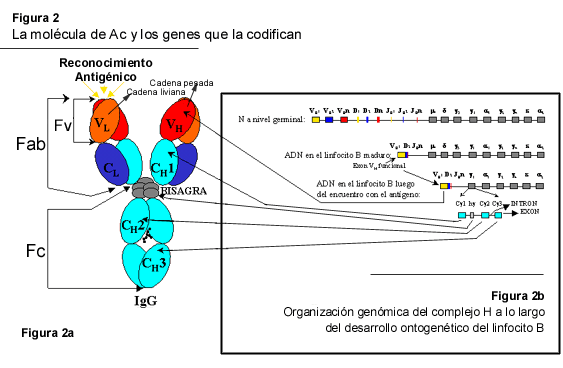
Los Ac son glicoproteínas solubles, sintetizadas y secretadas de manera exclusiva por un tipo particular de glóbulo blanco denominado linfocito B. Moléculas de Ac han sido encontradas, virtualmente, en todos los fluidos y cavidades corporales. En mamíferos se han descrito cinco clases de Ig a saber Ig M, G, A, D y E. Cada una de ellas posee, además de un metabolismo y fisiología característicos, rasgos estructurales y funcionales particulares. Sin embargo, todas comparten una estructura básica común que bien puede ser ejemplificada por la molécula IgG (Figura 2). Básicamente, la molécula de Ac consta de dos tipos de cadenas polipeptídicas, denominadas cadena liviana/ligera y cadena pesada, con pesos moleculares aparentes de unos 25 y 50 kD, respectivamente (Figura 2A y 2C). Se han identificado dos tipos de cadena liviana, kappa (k ) y lambda (l ), y cinco clases de cadena pesada, mu (m ), gamma (g ), alfa (a ), delta (d ) y epsilon (e ). Cada monómero de Ig, independientemente de la clase, consta de dos cadenas pesadas idénticas y dos cadenas livianas igualmente idénticas. Las cadenas pesadas establecen abundantes interacciones no covalentes y cierto número de enlaces covalentes (del tipo puente disulfuro) entre sí y con las cadenas livianas.

La característica bioquímica estructural más resaltante de las cadenas Ig es el "dominio Ig" (82). Muy resumidamente, un dominio Ig es una secuencia polipeptídica de unos 100-110 aminoácidos que presenta, de manera muy conservada, dos residuos de cisteína localizados hacia los extremos opuestos de la secuencia. Estos residuos permiten la formación de un puente disulfuro intracatenario importante para la estabilización de la estructura terciaria del dominio y, consecuentemente, de la molécula. La distribución de aminoácidos hidrofílicos e hidrofóbicos en la secuencia primaria del dominio trae como resultado la formación de lo que, en bioquímica de proteínas, se conoce con el nombre de hojas plegadas tipo b . Estas hojas b se organizan en forma antiparalela, se unen mediante segmentos relativamente cortos de secuencia llamados asas o "loops", en los cuales es usual encontrar la conformación tipo hélice a y se arreglan a nivel tridimensional para formar un par de láminas (Figura 3).

Estudios comparativos de la secuencia primaria de aminoácidos, en un número importante de moléculas de Ac, han permitido la identificación de dos tipos de dominio en las cadenas Ig: el dominio variable (V) y el dominio constante (C). Esta denominación obedece a la variabilidad encontrada en cada posición de la secuencia primaria. Tanto la cadena liviana como la pesada poseen un dominio variable designados VL y VH, respectivamente. La cadena liviana posee un único dominio constante (CL), mientras la cadena pesada posee tres o cuatro dominios constantes (CH1, CH2, CH3, CH4), dependiendo de la clase de Ig (Figura 2A). El dominio Ig tiene implicaciones importantes para la funcionalidad de la molécula de Ac. Por ejemplo, los dominios VL y VH se conjugan en un módulo funcional denominado Fv, en el cual se encuentra el sitio de reconocimiento del antígeno o paratopo (Figura 2A). Mediante la comparación de secuencias de aminoácidos disponibles para numerosos dominios VL y VH, ha sido posible identificar tres sitios en cada dominio V, denominados regiones hipervariables, en los que la variabilidad, en la secuencia primaria de aminoácidos, alcanza un máximo. Estas regiones contienen los residuos principales que conforman el paratopo y, por ello, también se les conoce con el nombre de regiones determinantes de complementariedad (RDC). Las RDC corresponden a las asas o "loops" de los dominios V (Figura 3) y se encuentran flanqueadas por regiones de menor variabilidad designadas marco (M) .
El dominio Ig ha sido explotado más allá del ámbito de los Ac, de manera que hoy se acepta la existencia de una superfamilia de proteínas que contienen en su estructura dominios Ig, Entre estas proteínas se cuentan, además de los Ac, el receptor antigénico de linfocitos T, las moléculas del sistema mayor de histocompatibilidad, receptores para el fragmento Fc de las Ig, moléculas de adhesión intercelular, etc. (61).
Genética y repertorio de inmunoglobulinas.
Los genes que codifican las Ig están organizados en complejos genéticos. Existe un complejo genético en el que se encuentran los elementos codificantes de todas las cadenas pesadas (complejo H) y dos complejos para las cadenas livianas, uno para la cadena k (complejo k ) y otro para la cadena l (complejo l ). El complejo H se encuentra localizado en la región telomérica del cromosoma 14 humano y está formado por un número variable de elementos codificantes denominados VH, DH, JH, hH y CH (Figura 2B). En forma similar, los complejos k y l contienen elementos VL, JL y CL, pero no poseen segmentos D ni h y están ubicados en los cromosomas 2 y 22 humanos, respectivamente. Cada complejo posee un número significativo de elementos V y, en menor cuantía, elementos D (complejo H) y J. Los elementos codificantes h y C constituyen exones completos, los cuales contienen la información estructural para la síntesis de la región bisagra (cadena pesada) y de los diferentes dominios constantes, respectivamente (Figura 2B).
Por otro lado, los dominios V son producidos a partir de la combinación de los elementos V, D y J. Durante la ontogenia del linfocito B estos complejos génicos sufren un interesante proceso de reordenamiento, o rearreglo, cuyos detalles mecanísticos no han sido del todo entendidos. Un sofisticado sistema de recombinación somática actúa sobre los elementos V, D y J, permitiendo en cada linfocito B el rearreglo funcional de un segmento VL con un segmento JL, para así generar un exón VL, el cual codifica el dominio VL de la cadena liviana. Algo similar ocurre con los segmentos VH, DH, y JH del complejo H (Figura 2B). Luego de que, en un linfocito B particular, ocurre el rearreglo funcional de estos segmentos y se genera un exón VL y uno VH, el proceso se detiene de manera que cada linfocito B despliega una única especificidad y es capaz de secretar, luego de la estimulación antigénica, únicamente Ac con esa especificidad. En humanos, se ha estimado que el proceso de rearreglo génico de los segmentos V, D, y J, en el cual se ven además involucrados fenómenos de adición de nuevos nucleótidos e inversión y uso simultáneo de varios segmentos D, tiene la potencialidad de generar 104 dominios VL y 108 dominios VH diferentes, pudiendo combinarse aleatoriamente para generar hasta 1012 moléculas de anticuerpo con especificidades diferentes. Este gigantesco repertorio permite al sistema inmune humoral disponer de la capacidad para reconocer y responder prácticamente ante cualquier reto antigénico.
